|
synthèse du géraniol, structure du nérol, concours chimie Capes 2007. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
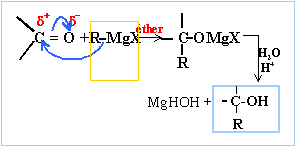
Des alcools isomères entre eux, se distinguent du citronellol par la présence d'une seconde double liaison mais avec le même squelette : le géranil de configuration E, le nérol de configuration Z et enfin le linalol qui est un isomère de position du nérol qui porte un groupe méthyle et un groupe hydroxyle en position 3. Synthèse du géraniol. Une des multiples synthèses du géraniol part du 1-chloro-3-méthyl-but-2-ène noté A. Le magnésien de A réagit avec le 4-chloro-3-méthyl-but-2-èn-1-ol (B) selon une réaction de type Würtz. On obtient un produit C. Le géraniol est le stéréoisomère de C de configuration E. Donner sa structure.
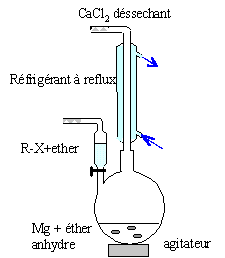
Donner le schéma expérimental du montage utilisé lors de la synthèse magnésienne en indiquant les précautions à prendre. colonne Vigeux ou réfrigérant
droit surmonté d'un dispositif
déshydratant contenant CaCl2. ampoule de coulée ; ajout goutte à
goutte du dérivé bromé ballon bicol contenant de l'éther anhydre
et les copeaux de magnésium Dispositif d'agitation RCl + RMgCl = R-R +
MgCl2. On l'évite en
ajoutant goutte à goutte le
dérivé chloré et en utilisant
le magnésium en
excès.
A la fin de cette synthèse le composé C est soluble dans la phase organique et on a deux phases. Une ampoule à décanter permet de séparer deux phases liquides non miscibles : la phase la plus dense ( solution aqueuse) occupe la partie inférieure ; la phase organique, la moins dense ( éther) occupe la partie supérieure. On achève la synthèse en séchant la phase organique en utilisant un déshydratantt : MgSO4 anhydre, Na2SO4 anhydre. Principe de l'évaporateur rotatif : distillation rapide d'un solvant Distillation sous vide partiel. On chauffe modérément la solution puis on fait décroître progressivement la pression jusqu'à ce que le solvant distille. Combien de stéréoisomères présente le composé C ? Absence de carbone asymétrique, une double liaison avec les mêmes groupes (methyle) et une seconde double liaison C=C: deux diastéréoisomères, isomérie de type Z E. Le spectre RMN 1H du géraniol, enregistré dans CDCl3 sur un appareil de 200 MHz, présente, entre autres, trois signaux caractéristiques dans la région comprise entre 4 et 6 ppm : - doulet ( intégration : 2H) entre 4,1 et 4,2 ppm ; - triplet ( intégration : 1 H) vers 5,1 ppm ; - triplet : intégration : 1 H vers 5,4 ppm.
(1) doublet ( intégration : 2H) entre 4,1 et 4,2 ppm : deux protons ont un seul H voisin. (2) triplet ( intégration : 1 H) vers 5,1 ppm : un proton éthylénique a deux H voisins équivalents (3) triplet : intégration : 1 H vers 5,4 ppm : un proton éthylénique a deux H voisins équivalents.
L'écart entre deux pics du signal centré à 4,14 ppm est de 0,037 ppm. Calculer la constante de couplage J ( Hz). On définit une grandeur sans unité, d déplacement chimique exprimée en ppm (parties par million). Appareil à champ constant : d = (nH-nTMS) / fréquence de l'appareil J = 0,037*200 = 7,4 Hz.
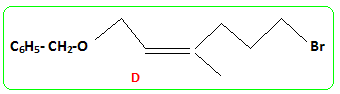
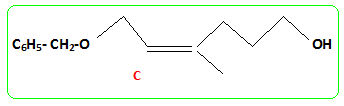
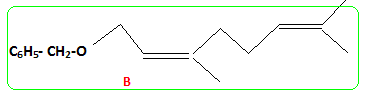
Structure du nérol. - Mis en présence d'hydrure de sodium NaH, puis de bromure de benzyle, le nérol conduit à un composé (B) . Le nérol noté R1OH réagit par sa fonction alcool. - L'ozonolyse partielle de (B) puis la réduction par NaBH4 dans l'éthanol fournit du propan-2-ol et un autre alcool (C) noté R2CH2OH. coupure d'une double liaison puis réduction des dérivés carbonylés en alcool.
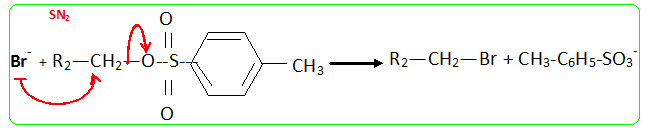
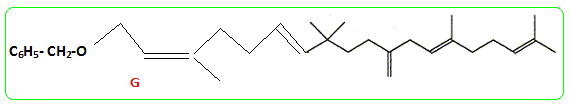
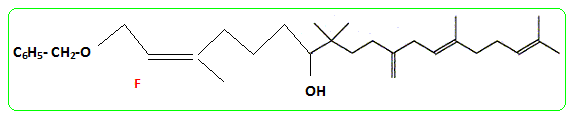
- Le traitement de (C) par le chlorure de paratoluène sulfonyle noté TsCl le transforme en tosylate R2CH2OTs dont le chauffage dans la propanone à reflux en présence de bromure de lithium permet d'obtenir un dérivé halogéné (D), R2CH2Br et la base conjuguée de l'acide paratoluène sulfonique TsOH. - Le magnésien préparé à partir de (D) réagit mole à mole avec un aldehyde (E). On obtient après hydrolyse acide, un produit (F) dont la déshydratation en milieu acide fournit majoritairement le composé (G). - Le traitement de (G) par un réactif approprié noté RX permet de scinder la fonction étheroxyde avec obtention de (H) et d'un dérivé benzylique suivant la réaction
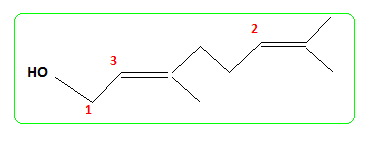
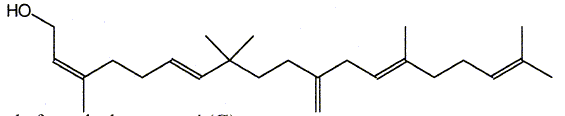
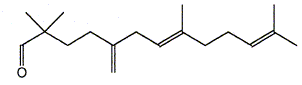
Le composé (H) est le monénocinol qui est un alcool lipidique obtenu lors de l'hydrolyse de deux antibiotiques : la monénomycine et la prasinomycine. Sa structure est représentée ci-après :
Donner la formule de G.
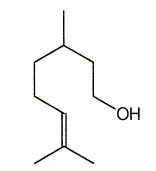
Donner la formule de (B). En déduire celle du nérol. ( isomère de configuration Z).
Ecrire le mécanisme de passage du nérol à (B). L'atome d'oxygène des alcools n'est pas suffisamment nucléophile pour déplacer directement des nucléofuges comme Br. La réactivité nucléophile de l'oxygène est exalter en passant par l'ion alcoolate. R1OH + NaH --> R1O- + Na+ +H2. puis substitution nucléophile SN1 : le substrat (RX) est un halogénure tertiaire benzylique : le carbocation C6H5-CH2+ est stabilisé par résonance.
R1O- +C6H5-CH2Br --> C6H5-CH2- O-R1 + Br-.
|
|||||||||||||||||||||||||||||
|
|
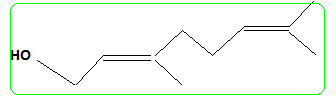
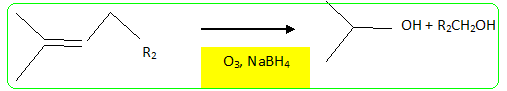
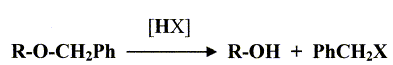
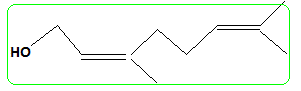 nérol.
nérol.