|
diagramme E-pH ; dosage de l'éthanol dans le rhum concours chimie Capes 2007. |
|||||||
|
|||||||
|
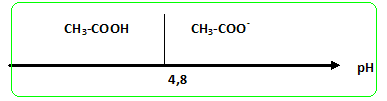
Tracer le diagramme de prdominance acido-basique en fonction du pH.
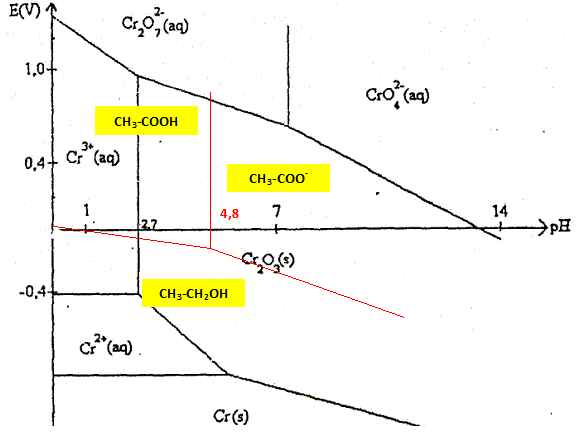
En solution aqueuse, l'acide éthanoïque est un oxydant dont le réducteur associé est l'éthanol. Ecrire la demi-équation électronique correspondante. CH3-COOH +4 H+ + 4e- = C2H5OH + H2O. On souhaite tracer le diagramme potentiel -pH en solution aqueuse relatif aux trois espèces CH3-COOH, CH3-COO-, C2H5OH. par convention, à la frontière entre deux espèces dissoutes, les concentrations des deux espèces sont égales. Quel sont les domaines de pH à considérer ainsi que le couple Ox / red correspondant à chacun des domaines ? pH < 4,8 : CH3-COOH / C2H5OH ; E°1 = 0,037 V ; CH3-COOH +4 H+ + 4e- = C2H5OH + H2O. pH > 4,8 : CH3-COO- / C2H5OH ; CH3-COO- +5 H+ + 4e- = C2H5OH + H2O. Donner l'expression du potentiel de chaque couple. E1 = E°1 (CH3-COOH / C2H5OH) + 0,06/4 log ([CH3-COOH][H+]4 / [C2H5OH]) E1 = 0,037 -0,06 pH (1) E'1 = E°1 (CH3-COO- / C2H5OH) + 0,06/4 log ([CH3-COO-][H+]5/ [C2H5OH] ) E'1 = E°1 (CH3-COO- / C2H5OH) + 0,06/4 log ([CH3-COO-][H+]5 / [C2H5OH] ) Constante d'acidité Ka = [CH3-COO-][H+] / [CH3-COOH] E1 = E°1 (CH3-COOH / C2H5OH) + 0,06/4 log ([CH3-COO-][H+]5 / (Ka[C2H5OH]) E1 = E°1 (CH3-COOH / C2H5OH) + 0,06/4 log (1/Ka) +0,06/4 log ([CH3-COO-][H+]5 / [C2H5OH])) On identifie : E°1 (CH3-COO- / C2H5OH) à E°1 (CH3-COOH / C2H5OH) + 0,06/4 log (1/Ka) E°1 (CH3-COO- / C2H5OH) =E°1 (CH3-COOH / C2H5OH) + 0,06/4 log (1/Ka) E°1 (CH3-COO- / C2H5OH) =0,037 +0,06/4 *4,8 - 0,06 / 4 *14*5 =0,037+0,072 =0,109 V E'1 = 0,109 + 0,06/4 log ([CH3-COO-][H+]5 / [C2H5OH]) = 0,109 -0,06*5/4pH E'1 =0,109 - 0,075 pH (1')
Dosage de l'éthanol dans le rhum. On oxyde l'éthanol par un excès de dichromate de potassium en milieu acide. L'excès de dichromate est ensuite dosé par le sel de Mohr dont la formule est FeSO4, (NH4)2SO4, 6H2O. le repérage de l'équivalence est obtenu en utilisant un indicateur coloré redoxx, le diphényle amine sulfonate de baryum, violet en milieu oxydant et incolore en milieu réducteur (E°=0,84 V). En fait le milieu passe du violet au vert à ll'équivalence du fait de la présence des ions Cr3+ qui sont de couleur verte. On prépare une solution diluée de rhum de concentration c0 en diluant 500 fois le rhum. Comment procéder pour préparer 1,00 L de cette solution diluée ? Prélever 1000 / 500 = 2,0 mL de rhum à l'aide d'une pipette jaugée + pipeteur. Placer dans une fiole jaugée de 1,00 L et compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène. On prépare également une solution de sel de Mohr à 40,0 g/L. Cette solution peut se trouler légrèrement et devenir jaune orangé. Oxydation de l'ion fer (II) Fe2+ par l'oxygène dissout puis précipitation de Fe(OH)3 si le milieu n'est pas suffisamment acide. Mode opératoire. Dans un erlenmeyer de 250 mL on introduit sucessivement : - 10,0 mL de solution diluée de rhum - 20,0 mL de solution de dichromate de potassium à 5,00 g/L - 10 mL d'acide sulfurique concentré. On agite puis on laisse reposer 20 min, la réaction étant lente. Au bout de 20 min on ajoute quelques gouttes d'indicateur coloré. dans la burette, on introduit la solution de sel de Mohr. On ajoute la solution de sel de Mohr et la solution contenue dans l'erlenmeyer devient verte pour un volume ajouté VE = 13,5 mL. Ecrire les équations des réactions d'oxyd-réduction mises en jeu dans ce dosage. Potentiels redox des couples CH3COOH / C2H5OH = 0,037 V ; Cr2O72- / Cr3+ = 1,36 V ; Fe3+ / Fe2+ = 0,77 V Les valeurs des potentiels redox étant suffisamment différentes ( écart supérieur à 0,30 V), les réactions peuvent être considérées comme quantitatives. Etape 1 : oxydation de l'éthanol : 3 fois { C2H5OH +H2O = CH3COOH + 4H+ + 4e- } oxydation alcool 2 fois { Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O } réduction de l'ion dichromate 3C2H5OH + 2Cr2O72- +16H+= 3CH3COOH + 4Cr3+ + 11 H2O (1) Etape 2 : dosage de l'ion dichromate en excès : 6 fois { Fe2+ = Fe3+ +e- } oxydation de l'ion fer II Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O Cr2O72-
+6Fe2+
+14H+ = 6Fe3++
2Cr3+ + 7
H2O
(2)
On donne : M du sel de Mohr = 392,16 g.mol -1 ; M dichromate de potassium : 294,2 g/mol ; M de l’éthanol = 46,0 g.mol -1 ; Masse volumique de l’éthanol à 20°C = 790 kg.m-3 solution de dichromate de potassium à 5,00 g/L : [Cr2O72- ] =5,00 /294,2 = 0,0170 mol/L solution de sel de Mohr à 40,0 g/L : [Fe2+]= 40,0 / 392,16 = 0,102 mol/L. Quantité de matière initiale de dichromate de potassium : n0. 20,0 mL de solution de dichromate de potassium à 5,00 g/L : n0 = [Cr2O72- ] *0,020 = 0,0170*0,020 = 3,40 10-4 mol Quantité de matière en excès de dichromate de potassium : nexcès. Cr2O72- +6Fe2+ +14H+ = 6Fe3++ 2Cr3+ + 7 H2O (2) Quantité de matière d'ion fer (II) à l'équivalencec : n(Fe2+) =[Fe2+] VE =0,102*0,0135 =1,377 10-3 mol nexcès = n(Fe2+) /6 =1,377 10-3 /6 = 2,295 10-4 mol Quantité de matière de dichromate de potassium oxydant l'alcool : n0-nexcès. 3,40 10-4 - 2,295 10-4 = 1,105 10-4 mol.
|
|||||||
|
|