|
Alcool : propriétés physiques, spectroscopie chimie concours Capes 07 |
|||||||||||||||||||
|
|||||||||||||||||||
|
Les atomes de carbone mettent en oeuvre 4 liaisons simples selon les directions d'un tétraèdre ( type AX4). L'atome d'oxygène met en oeuvre deux liaisons simples l'une avec l'atome de carbone et l'autre avec un atome d'hydrogène. La géométrie autour de l'atome d'oxygène est du type AX2E2 ( en forme de V). Les paires non liantes occupant en moyenne un volume plus grand que les paires liantes, on prévoit un angle entre les liaisons inférieur à 109°. A quel phénomène peut-on attribuer les valeurs élevées des températures d'ébullition des alcools comparées à celles des alcanes correspondants ? Association des molécules d'alcool par liaison hydrogène : Les liaisons hydrogène existent chaque fois que l'atome d'hydrogène est lié à un atome très électronégatif (F, S, O). La petite taille de l'atome d'hydrogène permet à ce dernier d'approcher très près de l'atome électronégatif et d'interagir fortement avec lui. Les alcools de faible masse moléculaire ( moins de 5 atomes de carbone) sont très solubles dans l'eau, contrairement aux alcanes correspondants. L'eau est un solvant polaire : il se forme facilement des liaisons hydrogène entre les molécules d'alcool et d'eau. Avec l'allongement de la chaîne hydrocarbonée, le groupe hydroxyle représente une fraction de plus en plus faible de la masse moléculaire : la solubilité dans l'eau diminue, par contre la solubilité dans les solvants non polaires comme l'hexane va croître.
Transmittance T,
grandeur portée en ordonnée d'un
spectre
IR. Lorsqu'une lumière monochromatique
d'intensité I0 traverse un milieu
homogène, l'intensité de la
lumière émergente I
décroît exponentiellement lorsque
l'épaisseur l du milieu absorbant
augmente. I = I0 . e (-
al) a est une constante appelée
coefficient d'absorption,
caractéristique du milieu et de la longueur
d'onde considérés. Dans le cas des solutions, la loi de Beer fait
intervenir les concentrations. I = I0 . e (-
elc) où e
est un coefficient caractéristique de
la substance appelé coefficient d'absorbance
(L mol-1
cm-1),
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la
solution
(mol/L). Cette loi est vérifiée lorsque la
solution est de concentration inférieure
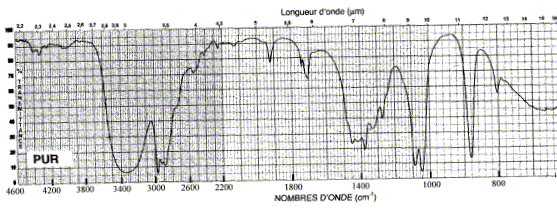
à : c < 0,1 mol.L-1. A= log (I0/I) = elc ( A est l'absorbance ou densité optique) e est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe. Absorbance et concentration étant proportionnelles, cette relation peut être utilisée pour réaliser des dosages ou des suivis cinétiques. La transmission T est définie comme le rapport de l'intensité transmise à l'intensité incidente. T = I / I0 ; log T= -A. Les différentes régions du spectre IR. De 5000 à 1250 cm-1 : " groupes fonctionnels" ; modifications des états vibrationnels de différentes liaisons, caractéristiques du type de liaisons. L'énergie absorbée provoque des transitions entre niveaux d'énergie correspondant aux vibrations de valence des liaisons De 1250 à 680 cm-1 : " empreinte digitale" Les bandes d'absorptions sont associées à des variations complexe de l'énergie vibrationnelle et rotationnelle de l'ensemble de la molécule ; elles sont caractéristiques de celle-ci. Spectre infrarouge de l'éthanol.
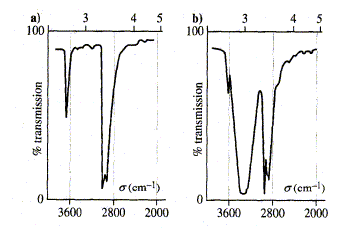
Le spectre "a" présente une bande étroite vers 3700 cm-1 : groupe hydroxyle libre, non associé ( éthanol en phase vapeur) Le spectre "b" présente une bande large vers 3400 cm-1 : groupe hydroxyle associé par liaison hydrogène ( éthanol en solution dans le tétrachlorométhane). Ce déplacement de la fréquence d'environ 300 cm-1 est dû à la présence des liaisons hydrogène qui affaiblissent la liaison O-H : en conséquence la fréquence diminue. RMN du proton. Le déplacement chimique : On soumet une molécule à un champ magnétique externe : ce dernier agit sur les spins nucléaires et induit dans un plan perpendiculaire à sa direction, une circulation des électrons autour du proton. Le champ externe induit un champ magnétique interne de même sens ( déblindage du proton) ou de sens contraire ( blindage du proton). Plus le blindage est intense, plus le champ extérieur devra être fort pour produire la résonance du proton : on observe un déplacement des pics d'absorption vers la droite du spectre. Blindage ou déblindage dépendent donc de l'environnement du proton. Le signal des protons du tétraméthylsilane - TMS - Si(CH3)4 introduit en petite quantité dans l'échantillon sert de référence. Pour un proton donné, l'écart entre la valeur du champ pour lequel il résonne et cette référence s'appelle son déplacement chimique par rapport au TMS. On définit une grandeur sans unité, d déplacement chimique exprimée en ppm (parties par million). Appareil à champ constant : d = (nH-nTMS) / fréquence de l'appareil Appareil à fréquence constante : d = (BTMS-BH) / champ de l'appareil. Condition concernant le noyau pour observer un signl en RMN : Le noyau doit posséder des propriétés magnétiques caractérisées par l'existence d'un spin nucléaire I non nul. Le spin nucléaire est nul lorsque A et Z sont pairs.
|
|||||||||||||||||||
|
|