|
extraction de l'acide benzoïque, chromatographie : concours Capes interne 2004 |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
Si le solvant organique utilisé pour l’extraction est volatil, il sera facilement éliminé, par exemple par évaporation à l’aide d’un évaporateur rotatif. On veut extraire l’acide
benzoïque de la solution saturée d’acide
benzoïque notée S2 ( 2,3
10-2 mol/L ) à
l’aide d’un solvant approprié. On dispose
de trois solvants : dichlorométhane, éthanol
et éther éthylique. Dans un livre de chimie,
on a trouvé les données suivantes
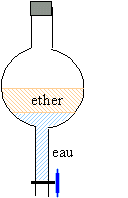
: C6H5COOH doit être très soluble dans le solvant ; ce solvant ne doit pas être miscible à l'eau : donc éther éthylique. On procède à l’extraction en versant 40 mL de solution S2 et 20 mL de S dans une ampoule à décanter. Après agitation vigoureuse et dégazage, on laisse décanter. Faire un schéma de l’ampoule et de son contenu après décantation. Indiquer clairement dans quelle phase se trouve l’acide benzoïque. Dans l'ampoule à décanter la phase aqueuse, la plus dense occupe la partie inférieure ; l'éther et l'acide benzoïque occupent la partie supérieure.
On récupère la totalité de la phase aqueuse que l’on dose par une solution de soude de concentration C1 = 2,0 x 10-3 mol.L-1, en présence de phénolpthaléïne. Le virage de l’indicateur a lieu pour un volume de soude versé VE = 8,2 mL. En déduire la quantité de matière ( en mol ) d’acide benzoïque que contient la phase aqueuse ( on la notera naq ). naq = C1VE = 2,0 x 10-3 *8,2 10-3 =1,64 10-5 mol ~1,6 10-5 mol. Le rendement R d’une extraction est défini comme le quotient de la quantité de soluté extrait par la quantité totale de soluté présent initialement. Déduire des résultats précédents le rendement de cette extraction simple. solution saturée d’acide benzoïque notée S2 ( 2,3 10-2 mol/L ) ; on procède à l’extraction en versant 40 mL de solution S2: n (acide benzoïque) total = 2,3 10-2 *40 10-3 =9,2 10-4 mol. nS = 9,2 10-4 -1,64 10-5 =9,04 10-4 mol. Rendement : nS / n (acide benzoïque) total =9,04/9,2 =0,98 ( 98 %)
K =[ C6H5COOH ]S / [ C6H5COOH ]aq. où interviennent les valeurs des concentrations ( en mol.L-1 ) de l’acide benzoïque dans les deux phases. Calculer la valeur de K grâce aux résultats précédents. [ C6H5COOH ]S = norg / Vorg ; [ C6H5COOH ]aq= naq / Vaq ; K = norg Vaq / ( naqVorg ) = 9,04 10-4 *40 / ( 1,64 10-5 *20) =109,6 ~ 110. On veut comparer ici l’efficacité d’une simple et d’une double extraction. On reprend 40 mL de solution S2 mais on procède ici à deux extractions successives avec 10 mL de solvant S. Après la première extraction, on récupère 10 mL d’une phase organiquenotée Sorg. On reprend ensuite la phase aqueuse et on réalise une seconde extraction. On récupère alors 10 mL d’une phase organique Sorg’. On réunit ensuite les deux phases Sorg et Sorg’. On note Sorg’’ ( de volume 20 mL ) la phase organique récupérée au terme de cette manipulation. Calculer les quantités de matière d’acide benzoïque ( en mol ) n1, n1’ et n1’’ dans les trois phases organiques Sorg, Sorg’ et Sorg’’ en supposant que le coefficient de partage K est constant. norg + naq = N = 9,2 10-4 mol ; naq = N-norg; repport dans l'expression de K. K = norg Vaq / ( naqVorg ) = norg Vaq / ((N-norg)Vorg ) ; KNVorg -KnorgVorg =norg Vaq ; norg(KVorg +Vaq ) = KNVorg ; norg = KNVorg / (KVorg +Vaq ) Pour la première extraction le volume de solvant est ½ Vorg , d'où : norg = KN½Vorg / (K½Vorg +Vaq ) = KNVorg / (KVorg +2Vaq ) norg =110*20 N / (110*20+80) =0,965 N ; naq = N-0,965 N = 0,035 N. Pour la seconde extraction, faire un calcul identique en remplaçant N par 0,035 N. norg' =0,965*0,035 N = 0,0338 N ; norg +norg' = (0,965 + 0,0338)N =0,999 N. En déduire le rendement de cette extraction double. 99,9 % Comparer alors l’efficacité des deux extractions, simple et double ; conclure. L'extraction double est plus efficace que l'extraction simple à volume de solvant identique.
|
|||||||||||||||||||||||||||||||
|
|