On traite le sulfure d'argent par du
dioxygène à haute température.
Les diagrammes d'Ellingham permettent d'étudier
les aspects thermodynamiques de la réaction
d'oxydation d'un métal par le dioxygène. La
réaction de référence est la
réaction d'oxydation d'un métal
rapportée à une mole de dioxygène :
métal( s ou l) + O2 (g) = Oxyde ( s ou
l)
Soit dans le cas de l'argent : 4Ag(s) + O2
(g) =2Ag2O(s) (1)
On se place dans le cadre de l'approximation d'Ellingham
: DrH° et
DrS° ne
dépendent pas de la température.
Expression de l'enthalpie libre
standard DrG°1
en fonction de la température pour la réaction
(1) :
|
espèce
|
O2(g)
|
Ag(s)
|
Ag2O(s)
|
|
DfH°
kJ mol-1
|
0
|
0
|
-31,1
|
|
S° J K-1
mol-1
|
205
|
42,5
|
121
|
Température de fusion de l'argent : 1235 K ;
température de fusion du sulfure d'argent : 1110 K ;
enthalpie molaire de fusion de l'argent DrH°F
= 11,3 k mol-1.
L'oxyde d'argent reste solide dans le domaine 298K ; 2000
K.
domaine 298 K ; 1235 K : DrH°
= 2DfH°
(Ag2O(s)) -DfH°
(O2 (g))-4DfH°(Ag)
= 2*(-31,1) = -62,2 kJ mol-1.
DrS° =
2S° (Ag2O(s)) -S° (O2
(g))-4S°(Ag) = 2*121-205-4*42,5 = -133 J K-1
mol-1.
DrG°1
= DrH°-TDrS°
= -62,2 103 +
133T ( J mol-1)
|
|
domaine 1235 K ; 2000 K :
DrH° =
2DfH°
(Ag2O(s)) -DfH°
(O2 (g))-4DfH°(Ag)
- 4DrH°F
(Ag)= 2*(-31,1)-4*11,3 = -107,4 kJ
mol-1.
DrS°
= 2S° (Ag2O(s)) -S°
(O2 (g))-4S°(Ag) - 4DrH°F
(Ag) /TF = 2*121-205-4*42,5-4*11,3
103 / 1235 = -169,6 J K-1
mol-1.
DrG°1
= DrH°-TDrS°
= -107,4 103 +
169,6T ( J
mol-1)
|
On considère que la pression totale est égale
à 1,00 bar, l'air contenant 20 % de dioxygène.
Température
d'équilibre entre l'argent et l'oxyde d'argent
à
l'équilibre.
4Ag(s) + O2 (g) =2Ag2O(s) ;
K =1/PO2 = 5.
De plus DrG°1
=-RT ln K = -RT ln 5 = -1,61 RT = -1,61*8,31 T =
-13,37 T.
Hypothèse : T est comprise
entre 298 et 1235 K : -62,2 103 + 133T=
-13,37 T ; T = 425
K.
Domaine de température
où tout l'oxyde d'argent est transformé en
argent à l'air
libre.
2Ag2O(s) = 4Ag(s ou l) +
O2 (g) ; K =0,2.
DrG°
-RT ln K doit être négatif
: +62,2
103 - 133T < -RT ln 0,2 ;
+62,2 103 - 133T
<13,37 T ; T > 425
K.
L'argent comme le mercure
correspondent à une enthalpie libre standard
d'oxydation faiblement négative à
température ordinaire ( ils sont tous deux
situés très haut dans le diagramme d'Ellingham
), contrairement à la plupart des autres
métaux. Argent et mercure ont été
découvert avant les autres métaux, la
réduction de leur oxyde s'effectuant à
température peu élevée.
Le sulfure d'argent est introduit dans un four en
présence de dioxygène. Il se produit la
réaction (2) :
Ag2S+O2(g)
=2Ag + SO2(g).
Calcul de la constante de
réaction à 298
K.
|
espèce
|
O2(g)
|
SO2(g)
|
Ag(s)
|
Ag2S(s)
|
|
DfH°
kJ mol-1
|
0
|
-296,8
|
0
|
-32,6
|
|
S° J K-1
mol-1
|
205
|
248
|
42,5
|
144
|
Température de fusion de l'argent : 1235 K ;
température de fusion du sulfure d'argent : 1110
K.
DrH° =
DfH°
(SO2(g)) +2DfH°
(Ag) -DfH°
(O2 (g))-DfH°(Ag2S)
= -296,8+32,6 = -264,2 kJ mol-1.
DrS° =
S° (SO2(g)) +2S° (Ag) -S°
(O2 (g))-S°(Ag2S) =
248+2*42,5-205-144= -16 J K-1
mol-1.
DrG°2
= DrH°-TDrS°
= -264,2 103 + 16*298 =
-2,59 105 ( J mol-1)
De plus DrG°2
=-RT ln K =-8,31 *298 ln K ;
K = 3,2
1045.
Dans la pratique, on travaille à 1060°C afin
d'augmenter la vitesse de la réaction.
|
|
On désire récupérer
l'argent contenu dans 9,607 g de sulfure d'argent.
Cette masse est introduite dans un four à
1060°C avec une quantité suffisante
d'air, la pression totale étant fixée
à 1,00 bar.
Masse d'argent
récupérable :
On donne Ag : 107,9 ; S : 32,1 g/mol.
M(Ag2S) = 2*107,9 + 32,1 =247,9 g/mol
; n= m/M = 9,607 /247,9 = 3,875 10-2
mol.
n(Ag) = 2 n = 7,750 10-2 mol.
masse d'argent : m = n(Ag) M(Ag) = 7,750
10-2 *107,9
=8,363 g.
Il faut aérer le four afin que le
dioxygène reste le réactif en
excès.
Le dioxyde de soufre peut être
pièger de la manière suivante :
- barbotage dans une solution de permanganate de
potassium acidifiée
- barbotage dans une solution basique,
SO2 étant un oxyde acide.
Pureté de l'argent
obtenu.
A lasortie du four on obtient des ppites
métalliques dont on voudrait estimer la
pureté. l'argent pur cristallise dans le
système cubique face centré (
c.f.c).
Configuration
électronique de l'élément
argent ( Z = 47) dans son état
fondamental.
1s2 2s2 2p6
3s2 3p6 4s2
3d10 4p6 5s1
4d10.
Maille conventionnelle
du système c.f.c.
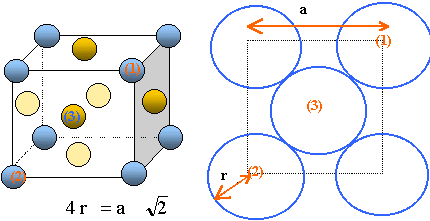
Il y a contact des sphères suivant la
diagonale d'une face du cube.
Une maille primitive ou maille simple est le
motif géométrique le plus simple qui,
en se répétant indéfiniment,
constitue un réseau cristallin. Une maille
primitive contient un nœud du réseau
à chaque sommet, mais aucun nœud
à l'intérieur de son volume ou de
l'une de ses faces.
Densité de
l'argent pur.
On donne le rayon métallique de l'argent
: 144 ppm.
Chaque maille compte en propre :
- Chaque atome d'argent situé au centre
d'une face, donc commun à deux mailles
compte pour ½ : il y a 6 faces soit 6*0,5 = 3
atomes d'argent
- Chaque atome situé à un sommet,
donc commun à huit mailles compte pour 1/8 :
il y a huit sommets donc 7 /8 atome d'argent.
donc 4 atomes d'argent propre a une maille.
a = 4 r / 2½ = 4*144
10-12/2½ =4,072
10-10 m ; volume de la maille
a3 = 6,756 10-29
m3.
masse de la maille : 4M(Ag) /NA =
4*107,9 10-3 / 6,02 1023 =
7,169 10-25 kg.
masse volumique : r =
7,169 10-25 / 6,756 10-29
=1,061 104 kg m-3 = 10,61 g
cm-3 ; d =
10,61.
L'argent obtenu à la suite de cette
opération de recyclage a une densité
mesurée de 10,34 : l'argent n'est pas
pur.
Méthode pour
déterminer la densité d'un
solide.
pesée du solide sur balance
électronique ; mesure de son volume par
déplacement d'un liquide ( l'eau) ; puis
diviser la masse (g) par le volume du solide (
cm3).
|
