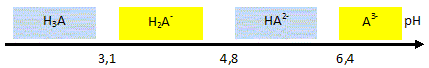|
Acide citrique, fructose, thermochimie, polarimétrie, Bts QIABI 2009 |
|||||||||||||||||
|
|||||||||||||||||
|
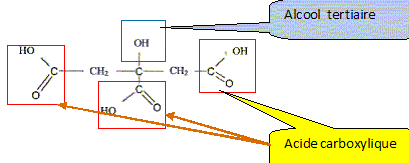
Poire (46%), (purée et morceaux), eau, sucre inverti, sucre, acide citrique, oligofructose, stabilisants (farine de graines de caroube, pectine, carraghénanes), protéines de lait et lactose, arôme. Le mélange des ingrédients qui est pasteurisé, homogénéisé et maturé avant d'être congelé, est appelé le « mix ». La congélation maintient la température au coeur du sorbet jusqu'à -18°C. Ce procédé provoque la cristallisation en glace de l'eau contenue dans les aliments. Etude de l'acide citrique ( 4 points) Données : H3A / H2A- : pKa1 = 3,1 ; H2A- / HA2- : pKa2 = 4,8 ; HA2- /A3-: pKa3 = 6,4. L'acide citrique est le nom courant de l'acide 3-carboxy-3-hydroxy-pentanedioïque, de masse molaire 192 g/mol. On donne sa formule semi-développée : Entourer et nommer les groupes fonctionnels.
Écrire les équations des réactions de dissociation observées lors de sa mise en solution dans l'eau. (L'acide citrique peut être noté H3A) H3Aaq + H2O liq = H2A-aq + H3O+aq ; H2A- + H2O liq = HA2- aq + H3O+aq ; HA2- + H2O liq = A3-+ H3O+aq.
On dose 10 mL de la solution d'acide citrique
par une solution d'hydroxyde de sodium NaOH
à 1,0 rnol/L. On donne l'équation du
dosage : H3A + 3HO- =
A3- + 3H20 L'équivalence est observée pour un
volume VNaOH = 7,8 mL. Déterminer la
concentration molaire puis la concentration
massique de la solution d'acide
citrique. A l'équivalence les quantités de
matière des réactifs sont en
proportions stoechiométriques : n(NaOH) = CNaOH VNaOH =1,0
* 7,8 10-3 =7,8 10-3 mol n(H3A) = n(NaOH) /3= 7,8 / 3
10-3 =2,6 10-3 mol dans 10
mL [H3A] = n(H3A) /
Vacide citrique= 2,6 10-3 /
10-2 =0,26
mol/L. titre massique = [H3A] * M(
acide citrique) = 0,26*192 =49,9
= 50 g/L. Sachant que la recette indique un ajout de 10 L
de solution d'acide citrique pour préparer
100 kg de mix, le mix
respectera-t-il la législation ou faut-il
modifier la recette ? 49,9 *10 / 100 = 4,99 ~ 5,0 g d'acide citrique /
kg de mix. ( valeur conforme à la norme
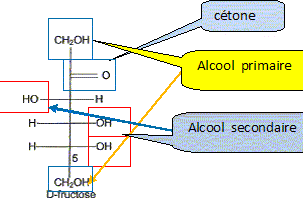
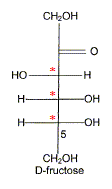
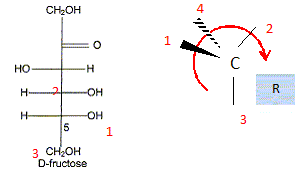
) Le principal glucide de la poire est le fructose qui a pour formule linéaire semi-développée : Entourer et nommer les différentes fonctions chimiques en précisant éventuellement la classe. De quel type de représentation s'agit-il ? Fischer. Définir un carbone asymétrique et repérer sur la molécule le(s) carbone(s) asymétrique(s). Atome de carbone tétragonal relié à
4 substituants différents. Définir le terme « chiral ». Une molécule chirale n'est pas superposable à son image dans un miroir. Classer les substituants du carbone 5 du fructose selon les règles C.I.P. et déterminer sa configuration absolue. par ordre de priorité -OH ; carbone 4 ; CH2OH ; H
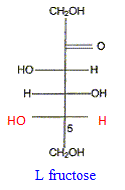
Donner la représentation de Fischer du L-fructose. L'énantiomère naturel est-il dela série D ou de la série L ? Dans la projection de Fischer, tous les oses dont l'hydroxyle porté par l'avant dernier carbone est à droite sont de la série D. Les sucres naturels sont en grande majorité de la série D.
Combustion du glucose : Écrire et équilibrer la réaction de combustion complète du glucose solide (formule brute : C6H1206) sachant qu'il se forme du dioxyde de carbone gazeux et de l'eau liquide. C6H1206(s) + 6O2(g) = 6 CO2(g) + 6H2O(l). Déterminer la variation d'enthalpie standard de combustion du glucose. On donne les enthalpies standard de formation :
DHr° = 6*(-393,5) + 6 (-285,8) - (-1268) = -2807,8 ~ -2808 kJ/mol. Déterminer la variation d'entropie standard de combustion du glucose sachant que la variation d'enthalpie libre standard de combustion du glucose est de - 2 867,5 kJ/mol à 298 K. DGr° =DHr° - TDSr° ; DSr°= (DHr° - DGr°) / T = (-2807,8+2 867,5) / 298 =0,2003 kJ mol-1 K-1 = 200,3 J mol-1 K-1.
Saccharose + eau = glucose + fructose DSr° = 4,66 J.mol-1.K-1 ; DHr° = - 26,2 kJ.mol-1. Déterminer l'enthalpie libre standard de cette réaction. DGr° =DHr° - TDSr° = -26,2 103 - 298*4,66 = -2,7589 104= -2,76 104 J mol-1. Conclure sur la spontanéité de la réaction dans le sens direct en justifiant. DGr° < 0 : la réaction évolue spontanément dans le sens direct ( vers la droite) Déterminer la constante de cet équilibre (sens 1). Que peut-on conclure sur cette réaction ? R = 8,314 J.mol-1.K-1. DGr° = -RT ln K ; ln K = -DGr° /(RT) = 2,7589 104 /(8,314*298) =11,14 ; K = 6,86 104. K est grand, la réaction est totale dans le sens direct. Dosage du sucre inverti par polarimétrie (4,5 points) On souhaite contrôler une des matières premières par polarimétrie : le sucre inverti. Définir le terme « substance optiquement active ». solide, liquide ou substance dissoute en solution provoquant une rotation du plan de polarisation de la lumière polarisée traversant la substance. Rappeler la loi de Biot, en précisant la signification des grandeurs et leurs unités. Loi de Biot traduit la proportionnalité entre le pouvoir rotatoire d'un milieuet les concentrations en produits optiquement actifs (dextrogyres ou lévogyres) : a = [a]l, T.C.l a (°) angle de rotation du plan de vibration des ondes lumineuses ; [a] : pouvoir rotatoire spécifique ( ° m2 kg-1 ); C: concentration ( kg m-3 ) ; l : longueur (m) de cuve Le sucre inverti est obtenu par hydrolyse du saccharose selon la réaction suivante : C12H22011 + H20 ---> C6H1206 + C6H1206 Le saccharose est-il dextrogyre ou lévogyre? Justifier. Justifier l'appellation «sucre inverti» donnée au mélange obtenu après hydrolyse du saccharose. Une mesure de l'angle de rotation est effectuée à 20°C sur le sucre inverti (on estime que l'hydrolyse du saccharose a été totale) et la valeur obtenue est de -9,5°. Il existe deux variétés de substances optiquement actives : les substances lévogyres qui font tourner le plan de polarisation vers la gauche et les substances dextrogyres qui font tourner ce plan vers la droite. Par convention, une molécule lévogyre est notée (-), et une molécule dextrogyre est notée (+) Le saccharose est dextrogyre ; le glucose aussi ; mais le fructose est lévogyre. L'hydrolyse provoque l'inversion de son activité. Calculer les concentrations massiques en glucose et en fructose dans la solution de sucre inverti. Données : longueur du tube optique 1 = 1,0 dm Pouvoir rotatoire spécifique du glucose: [a]20 = + 52 ° L.kg-1.dm-1 Pouvoir rotatoire spécifique du fructose: [a]20 = - 92 ° L..kg-1.dm-1 Pouvoir rotatoire spécifique du saccharose: [a]20 = + 66 ° L.kg-1.dm-1 Les concentrations finales, notées C, du glucose et du fructose sont égales. a =( [a]20 glucose+[a]20 fructose ) C.l ; C = a /[( [a]20 glucose+[a]20 fructose ) l] C = -9,5 / (52-92) = 0,237 ~ 0,24 kg / L.
|
|||||||||||||||||
|
|