|
|
||||||||
|
||||||||
|
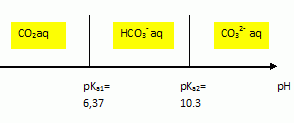
Elément calcium. Le symbole chimique du calcium étant 4020Ca, justifier la forme stable Ca2+ de cet élément à partir de sa structure électronique. L'atome de calcium compte 20 électrons : 1s2 2s2 2p6 3s2 3p6 4s2. L'ion calcium compte 18 électrons : 1s2 2s2 2p6 3s2 3p6. La couche électronique externe de l'ion Ca2+ est complète à 8 électrons : cet ion est donc stable. Le numéro atomique du carbone étant 6, celui de l'oxygène étant 8, donner la formule de Lewis de la molécule de dioxyde de carbone. Donner sa géométrie. La molécule de dioxyde de carbone est linéaire. 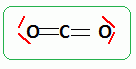 L'élément calcium est essentiellement présent sur Terre sous forme de carbonate de calcium ( calcaire). Le carbonate de calcium est utilisé pour la fabrication de la chaux (CaO) par calcination. La transformation correspond à l'équilibre chimique décrit par l'équation chimique suivante : CaCO3(s) = CaO(s) + CO2(g). Proposer un moyen simple de déplacer l'équilibre en faveur de la production de chaux. En éliminant l'un des produits ( ici le dioxyde de carbone gazeux ) au fur et à mesure qu'il se forme, on déplace l'équilibre dans le sens direct, formation de chaux. Les eaux souterraines. De l'eau initialement pure dans une région volcanique se retrouve dans une cavité calcaire profonde. La température y est de 25 °C et la pression partielle du dioxyde de carbone PCO2 est constante et égale à 0,35 bar. Le calcaire se dissout partiellement dans cette eau de même que du dioxyde de carbone. Le calcaire sera assimilé à du carbonate de calcium CaCO3(s) ; le terme concentration désigne la concentration molaire ; on ne considèrera que les transformations chimiques décrites par les équations chimiques suivantes et leurs constantes d'équilibre à 25°C indépendantes de la pression. CaCO3(s) = Ca2+aq + CO32-aq ; Ks =[Ca2+aq] [CO32-aq] = 4,47 10-9. CO2(g) = CO2 aq ; PCO2 = 30,1 [CO2 aq] CO2 aq + 2H2O(l) =HCO3-aq + H3O+aq ; Ka1 = [H3O+aq][HCO3-aq] / [CO2 aq] = 4,25 10-7. HCO3-aq + H2O(l) =CO32-aq+ H3O+aq ; Ka2 = [H3O+aq][CO32-aq] / [HCO3-aq] = 5,61 10-11.
Ka1 = [H3O+aq][HCO3-aq] / [CO2 aq] et PCO2 = 30,1 [CO2 aq] Ka1 = 30,1[H3O+aq][HCO3-aq] / PCO2. [HCO3-aq] = Ka1PCO2 / (30,1[H3O+aq]). Déterminer
l'expression littérale de [Ca2+aq ] à l'équilibre en fonction de Ka1,
Ka2, Ks,
PCO2 et [H3O+aq
]. Les équations trouvées donnent : [Ca2+aq] =1,61 1010[H3O+aq]2 et [Ca2+aq]= 2,47 10-9 / [H3O+aq]. Calculer
[Ca2+aq]
et [H3O+aq] à l'équilibre. Déterminer
le pH et la concentration en ion carbonate.
Cette même eau est pompée jusqu'à la surface où la pression partielle de dioxyde de carbone est plus faible et égale à 3,5 10-4 bar. La température reste à 25 °C. Justifier l'apparition de bulles dans l'eau lorsque celle-ci arrive en surface. Si la pression partielle PCO2 diminue, alors [CO2 aq] diminue et l'équilibre CO2(g) = CO2 aq est déplacé dans le sens indirect, formation de CO2(g). Pendant le pompage, le pH de l'eau augmente jusqu' à une valeur proche de 8. Expliquer pourquoi la réponse précédente est cohérente avec l'augmentation du pH. [CO2 aq] diminue : l'équilibre CO2 aq + 2H2O(l) =HCO3-aq + H3O+aq est déplacé dans le sens indirect : diminution de [HCO3-aq] et de [H3O+aq]. [HCO3-aq] diminue : l'équilibre HCO3-aq + H2O(l) =CO32-aq+ H3O+aq est déplacé dans le sens indirect : diminution de [CO32-aq] et de [H3O+aq]. La concentration [H3O+aq] diminue et en conséquence, le pH augmente. Pendant le pompage, la concentration en ion calcium passe de 4,6 10-3 mol/L en profondeur à 3,6 10-3 mol/L en surface. Une partie des ions calcium prècipite sous forme de calcaire qui entartrera les canalisations. Déterminer la masse de calcaire CaCO 3 ( M = 100 g/mol) qui se dépose pour un volume V = 1000 L d'eau puisée. Différence de quantité de matière par litre d'eau : 4,6 10-3 -3,6 10-3 =1,0 10-3 mol Soit pour 1000 L d'eau : 1,0 mol ou 100 g de calcaire. Le produit de solubilité de l'hydroxyde de calcium Ca(OH)2 est K's = [Ca2+aq][HO-aq]2= 8,0 10-6. Calculer le pH de précipitation de l'hydroxyde de calcium si [Ca2+aq] = 3,6 10-3 mol/L en surface. [HO-aq]= ([K's / [Ca2+aq])½ =([8,0 10-6/ 3,6 10-3)½ =4,71 10-2 mol/L pOH = -log (4,71 10-2 )=1,33 d'où pH = 14-pOH =14-1,33 =12,7 ~ 13. L'hydroxyde de calcium ne précipite pas en surface car le pH de l'eau est bien inférieure à la limite du pH de précipitation.
Détecteur thermostatique. Le détecteur comporte une thermistance dont la caractéristique est donnée : 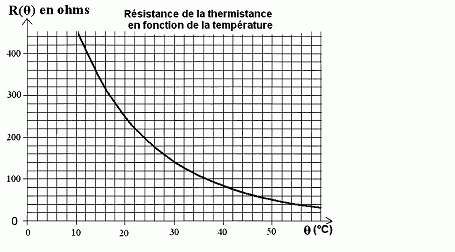 Déterminer la sensibilité "s" de la thermistance ( variation de sa résistance en ohm par degré celsius à la température q = 32 °C. Tracer la tangente à la courbe à q = 32 °C et déterminer son coefficient directeur. 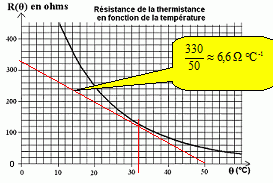 Cette thermistance de résistance R(q) et un conducteur ohmique de résistance R' réglable sont insérés dans le montage suivant : 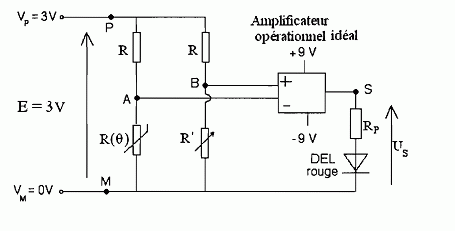 Quelle est l'utilité du conducteur ohmique RP ? Protection de la diode contre une surintensité. A quelle condition, sur les tensions US et UAB la diode considérée comme idéale est allumée ? US doit être positive ( + 9 V) : l'AO, fonctionnant en comparateur, doit être saturé à l'état haut. Le potentiel de l'entrée B doit être supérieur à celui de l'entrée A : VB-VA = UBA >0. La tension UAB doit donc être négative. La différence de potentiel entre les points A et B a pour expression :  On veut que la diode s'allume dès que la température est supérieure à 22 °C. Déterminer la valeur de R'. 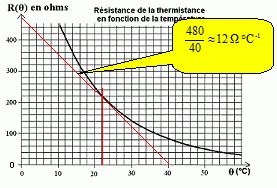 UAB < 0 ou nul ; R(q) - R'< ou nul ; R(q) = R' ; R' = R(22°C) = 12*22 ~2,6 102 ohms. |
||||||||
| |
||||||||
|
|