|
Pourquoi cuisiner dans des casseroles en cuivre ? ( bac S Amérique du Nord 2009) voir le site du lycée Rochambeau |
|||||||
|
|||||||
|
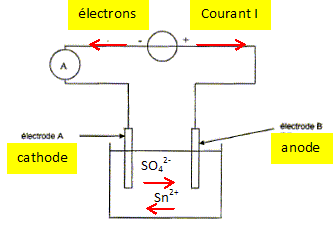
Pour éviter le contact toxique du vert de gris, on doit toutefois recouvrir les ustensiles en cuivre d'étain pur, aujourd'hui par électrolyse. D'après Hervé This, les secrets de la casserole. C'est par oxydation que le cuivre se recouvre de vert de gris. La couche obtenue donne un aspect particulier aux statues, mais elle est constituée d'un sel soluble qui est toxique. L'électrolyse du cuivre consiste dans ce cas à déposer une fine couche d'étain sur toute la surface du récipient. Ce procédé est appelé étamage. L'électrolyte est constitué de sulfate d'étain Sn2+aq + SO42-aq et de différents additifs. Le récipient à étamer constitue une électrode, l'autre étant de l'étain Sn(s) pur. On donne : M(Sn) = 119 g/mol ; 1 F = 9,65 104 C mol-1 ; couple oxydant / réducteur : Sn2+aq / Sn(s). Etamage d'une casserole. Compléter le schéma suivant en indiquant le sens du courant ainsi que le sens de circulation des porteurs de charge dans les conducteurs métalliques et dans la solution. Les cations se déplacent dans le sens des
ions Sn2+aq et les anions
dans le sens des ions sulfate. L'électrolyse
est-elle une transformation spontanée ?
Justifier. L'électrolyse est une transformation
forcée qui nécessite un apport
d'énergie sous forme d'énergie
électrique.
La réaction se produisant à l'électrode A reliée à la borne négative du générateur est-elle une oxydation ou une réduction ? Justifier et en déduire le nom de chaque électrode. L'électrode A reçoit des électrons de la part du générateur. Lors d'une réduction, une espèce (l'oxydant ) gagne un ou des électron(s). Une réduction se produit à la cathode. B est donc une anode. Ecrire l'équation de la réaction se produisant à l'électrode A Le récipient à recouvrir doit-il constituer cette électrode ? Justifier. Réduction des ion étain(II) suivant : Sn2+aq + 2e- = Sn(s)cathode. On observe un dépôt d'étain sur l'électrode A : c'est le but recherché ; la casserole à recouvrir constitue d'onc la cathode A. Ecrire l'équation de la réaction se produisant à l'autre électrode B. Le métal étain de l'anode s'oxyde : Sn(s)anode = Sn2+aq + 2e-. En déduire l'équation de la réaction globale de cette électrolyse. Comment évolue la concentration des ions Sn2+aq ? Sn2+aq +Sn(s)anode = Sn(s)cathode +Sn2+aq. Sn(s)anode = Sn(s)cathode Tout se passe comme s'il y avait un transfert de l'étain de l'anode sur la cathode. Pendant la même durée, il disparaît autant d'ion Sn2+aq à la cathode qu'il en apparaît à l'anode : la concentration des ions Sn2+aq reste constante dans la solution.
Donner l'expression de la quantité d'électricité Q qui a traversé le circuit au cours de l'électrolyse. Q = I Dt avec I (A), Dt (s) et Q ( coulomb) Donner la relation entre la quantité d'électrons n(e-) échangée et la quantité d'étain n(Sn) déposée sur le récipient. Sn2+aq + 2e- = Sn(s)cathode. Les nombres stoechiométriques conduisent à : n(e-) = 2 n(Sn). Donner la relation entre la quantité d'électrons n(e-) échangée et la quantité d'électricité Q. La charge, en valeur absolue, d'une mole d'électrons est 1 faraday : Q = n(e-) F = 9,65 104 n(e-). Montrer alors que la durée de l'électrolyse peut être exprimée, en fonction de la masse mSn déposée, par la relation : D t = 2 mSnF/ (I MSn). Ajoutons aux relations ci-dessus : n(Sn) = mSn / MSn ( masse divisé par masse molaire) D t = Q/ I ; D t =n(e-) F / I ; D t = 2 n(Sn)F / I ; D t =2mSnF / (I MSn ). On veut étamer une casserole cylindrique, de diamètre D=15 cm, de hauteur H=7,0 cm, et d'épaisseur négligeable. Le dépôt doit être réalisé sur les faces interne et externe et sur une épaisseur e = 20 µm. Le volume d'étain nécessaire est donné par la relation V = S e avec S = pi D2/2 + 2 pi D H. Calculer la valeur de V en cm3. S = 3,14 * 152/2 + 2*3,14*15*7,0 = 353,25+659,4=1012,65 cm2. e = 20 10-4 cm ; V = S e = 1012,65 * 20 10-4 =2,0253 ~2,0 cm3. La masse volumique de l'étain est r = 7,30 g cm-3. Calculer la masse d'étain nécessaire. m = r v = 7,30 * 2,0253 = 14,78 ~15 g. Calculer la durée minimale de l'électrolyse. D t =2mSnF / (I MSn ) = 2*14,78 *9,65 104 /(0,250*119) = 9,59 104 ~ 9,6 104 s.
L'aluminium est aussi utilisable en cuisine mais il est très réactif vis à vis des acides et des bases. Définir un acide au sens de Bronsted. Espèce, ion ou molécule susceptible de libérer un proton H+. Ecrire la réaction d'un acide AHaq avec l'eau. AHaq + H2O(liq) = A-aq + H3O+aq. Le pH d'un jus d'orange vaut pH1 = 3,0. En déduire la concentration des ions oxonium dans le jus. [H3O+aq]= 10-pH1 =1,0 10-3 mol/L. On mesure le pH d'un lait dans les mêmes conditions. On trouve pH2 = 6,7. Pour lequel de ces deux
ingrédients l'aluminium est-il le moins
recommandé ? En réalité l'aluminium est naturellement protégé de l'attaque des acides et des bases par recouvrement d'une couche d'oxyde appelé alumine.
|
|||||||
|
aux électrodes |
|||||||
|
|