|
Pile Daniell ; accumulateur au plomb ; pile à combustible bac S Amérique du sud 2008. |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
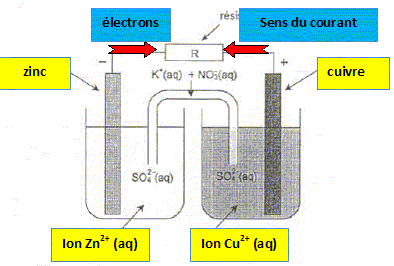
On se propose dans cet exercice d'étudier quelques caractéristiques de trois modèles de piles : une pile "classique ", celle de J. Daniell ; un accumulateur rechargeable ; une pile à combustible. La pile Daniell. Conçue en 1836 par le physicien britannique John Daniell, elle met en jeu les deux couples Zn2+(aq) / Zn(s) et Cu2+(aq) / Cu(s). Elle offre l'avantage sur la pile de Volta de délivrer un courant constant. Initialement, les deux solutions étaient séparées par une paroi en terre poreuse. Cette paroi fut remplacée par une feuille de parchemin permettant à la pile de débiter un courant plus intense. Le modèle présenté ci-dessous est constitué de deux demi-piles reliées par un pont salin au nitrate de potassium K+(aq) + NO3-(aq). Les solutions aqueuses de sulfate de zinc et de sulfate de cuivre utilisées ont la même concentration molaire en ions zinc et en ions cuivre : [ Cu2+ ] = [ Zn2+ ] = 1,0 mol/L. L'électrode positive de cette pile est l'électrode de cuivre. Légender le schéma en indiquant la nature de chaque électrode ; la nature des ions métalliques présents dans les béchers ; le sens conventionnel du courant et le sens du mouvement des électrons.
Écrire les équations des réactions qui se produisent aux électrodes en précisant pour chacune d'elles s'il s'agit d'une oxydation ou d'une réduction. En déduire l'équation de la réaction de fonctionnement de la pile. Zn(s) =
Zn2+(aq) + 2e-. Réduction des ions
Cu2+(aq) à la cathode positive :
Cu2+(aq) +
2e- = Cu(s) Bilan :
Zn(s) +
Cu2+(aq) = Zn2+(aq) +
Cu(s).
Donnée : Pour la réaction d'équation Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq), la constante d'équilibre vaut K =1,9 1037. Qr i est inférieur à K : le critère d'évolution spontanée indique une évolution dans le sens direct ( gauche à droite ). C'est à dire une réduction des ions cuivre (II) : cette réduction nécessite un apport d'électrons ( issu de l'oxydation du zinc) : les électrons se déplacent du zinc négatif vers le cuivre positif, à travers le circuit extérieur. Comment évoluent les concentrations des ions métalliques dans chacun des béchers ? La concentration des ions Zn2+(aq) augmente ; la concentration des ions Cu2+(aq) diminue. En déduire le sens du mouvement des ions présents dans le pont salin. Chaque solution doit rester électriquement neutre : en conséquence les ions négatifs NO3-(aq) migrent du pont salin vers la solution de sulfate de zinc ; des ions positifs K+(aq) migrent du pont salin vers la solution de sulfate de cuivre.
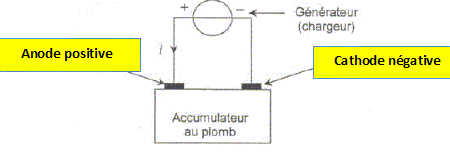
L'accumulateur au plomb. L'accumulateur au plomb a été inventé en 1859 par Gaston Planté. Robuste et bon marché, il peut débiter des courants de très grandes intensités (plusieurs centaines d'ampères). C'est pourquoi il est utilisé pour alimenter les démarreurs des moteurs thermiques (voitures et camions). Un élément d'accumulateur est constitué de deux électrodes, l'une en plomb Pb(s), l'autre en plomb recouverte d'oxyde de plomb PbO2(s). Ces deux électrodes sont immergées dans une solution aqueuse d'acide sulfurique. L'équation de la réaction de fonctionnement de l'accumulateur en générateur s'écrit : PbO2(s) + 4 H+(aq) + Pb(s) = Pb2+(aq) + Pb2+(aq) + 2 H2O(l) Identifier les deux couples oxydant/réducteur qui interviennent dans te fonctionnement de ce générateur. PbO2(s) / Pb2+(aq) et Pb2+(aq) / Pb(s). On s'intéresse dans ce qui suit à la charge de l'accumulateur. Lors de la charge, l'accumulateur joue le rôle d'électrolyseur. Un générateur de charge, de force électromotrice supérieure à celle de l'accumulateur impose le sens du courant. Indiquer l'anode et la cathode de l'accumulateur.
La transformation est-elle spontanée ou forcée ? L'électrolyse nécessite un apport d'énergie sous forme électrique : c'est une transformation forcée. Écrire l'équation de la réaction chimique qui modélise dans le sens direct la transformation chimique qui se produit lors de la charge. L'équation de la réaction de fonctionnement de l'accumulateur en récepteur ( charge) s'écrit : Pb2+(aq) + Pb2+(aq) + 2 H2O(l) =PbO2(s) + 4 H+(aq) + Pb(s). C'est à dire l'inverse de la réaction de fonctionnement en générateur. Comment évolue le quotient de cette réaction par rapport à la constante d'équilibre lors de cette transformation ? En récepteur ( charge) : Pb2+(aq) + Pb2+(aq) + 2 H2O(l) =PbO2(s) + 4 H+(aq) + Pb(s avec K =[H+(aq)]éq4 /[Pb2+(aq]éq2 ; Lorsque l'accumulateur est déchargé, les électrodes sont peu différenciées, [Pb2+(aq] est grand et la valeur de K est très faible. Qr = [H+(aq)]4 /[Pb2+(aq]2 ; Lors de la charge [Pb2+(aq] diminue et [H+(aq)] augmente, donc Qr augmente. Dans une réaction forcée, la valeur du quotient de réaction se différencie de plus en plus de celle de la constante d'équilibre K.
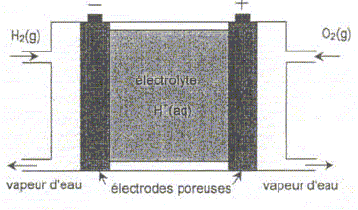
Calculer la quantité de matière de dihydrogène consommée pendant la durée du trajet.
H2(g) = 2 H+(aq) + 2 e - ; les nombres stoechiométriques indiquent que : ne- = 2 * n(H2) = 2,5 103 mol. Calculer la quantité d'électricité totale débitée par la pile, puis l'intensité du courant, supposée constante pendant la durée du trajet. Remarque : l'intensité calculée, très grande, ne correspond pas à la réalité car, dans une voiture, plusieurs éléments de pile sont montés en série. Données : Masse molaire atomique de l'hydrogène M(H) = 1,00 g.mol-1 1 faraday (1F) = 9,65 104 C.mol-1 ; constante d'Avogadro : NA =6,02 1023 mol-1 ; charge électrique élémentaire : e = 1,60 10 -19 C Quantité d'électricité Q = It = n F avec t = 6*3600+40*60 = 24000 s Q = 2,5 103*9,65 104 =2,4 108 C.
|
|||||||||||||||||||||||
|
|