|
Fraicheur d'un lait ( bac Stl biologie, génie biologique 2009) |
|||||||
|
|||||||
|
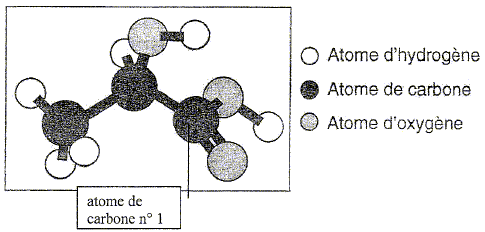
On se propose de vérifier la fraicheur d'un lait dont la bouteille a été ouverte depuis 8 jours et placée dans un réfrigérateur à la température de 5 °C. L'acide lactique. l'acide 2-hydroxypropanoïque encore appelé acide lactique a pour modèle moléculaire éclaté :
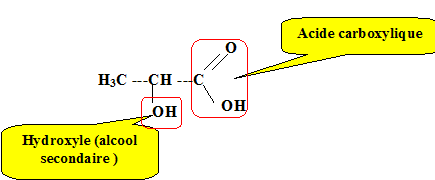
Ecrire la formule semi-développée de la molécule ; entourer et nommer les groupes fonctionnels présents.
Utiliser la méthode de Gillespie ( VSEPR) pour prévoir la géométrie autour de l'atome de carbone n°1. Trois directions de liaisons ; le carbone ne porte pas de doublet non liant : le type est AX3 et la structure est triangulaire plane. Titrage acido-basique. On prélève
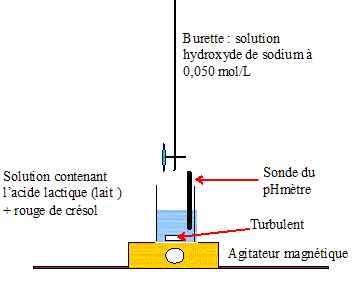
un colume VL = 25 mL de lait auquel on
ajoute 50 mL d'eau et quelques gouttes de
crésol. la solution titrate de soude a une
concentration C1=5,0 10-2
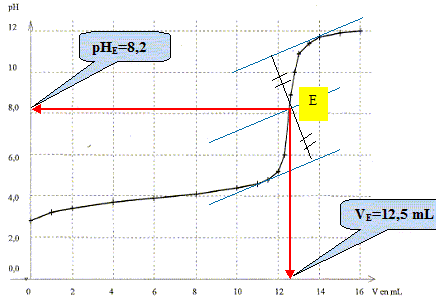
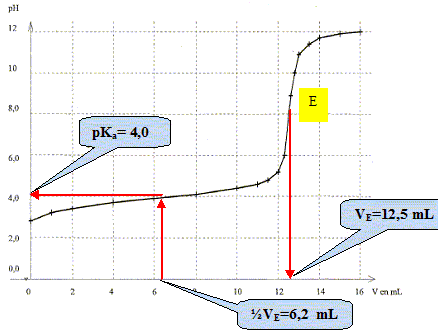
mol/L. Choisir dans la liste suivante le matériel nécessaire et indiquer le mode opératoire pour cette préparation. - pipettes jaugées de5, 10, 20, 25, 50 mL - fioles jaugées de 50, 100 et 1000 mL - burette de 50 mL - bechers de 50 et 100 mL. Facteur de dilution F =C0 /C1 =0,50 /5,0 10-2 =10 Volume de la pipette jaugée : V1 / F = 50 /10 = 5,0 mL. Prélever 5,0 mL de solution mère à l'aide d'une pipette jaugée de 5,0 mL ( + pipeteur) - Verser dans une fiole jaugée de 50,0 mL et compléter jusqu'au trait de jauge avec de l'eau distillée. Boucher, agiter pour rendre homogène. On mesure le pH du mélange réactionnel après chaque ajout de soude ; on obtient la courbe suivante donnant l'évolution du pH en fonction du volume V de soude versé. Faire un schéma annoté du montage utilisé.
Ecrire l'équation de la réaction de titrage. CH3-CH(OH)-COOH (aq) + HO-(aq) = CH3-CH(OH)-COO- (aq) + H2O(l). définir l'équivalence de la réaction de titrage. A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiomtriques ; avant l'équivalence, l'acide lactique est en excès ; après l'équivalence, la soude est en excès.
En déduire la concentration de l'acide lactique présent dans l'échantillon de lait.
C VL = C1 VE ; VE = C1 VE / VL =5,0 10-2 *12,5 / 25 = 0,025 mol/L. Justifier l'utilisation du rouge de crésol pour ce titrage. Zone de virage du rouge de crésol [ 7,0 . 8?8 ] Le pH du point équvalent est 8,2 ; la zone de virage de l'indicateur coloré doit contenir le pH du point équivalent. Le rouge de crésol convient donc. L'acide lactique est un monoacide. On le note AH. Ecrire l'équation de la réaction entre l'acide lactique et l'eau puis exprimer sa constante d'acidité Ka. AH (aq) + H2O(l) = A-(aq) + H3O+(aq) ; Ka = [A-(aq)] [H3O+(aq)] / [AH (aq) ]
|
|||||||
|
|