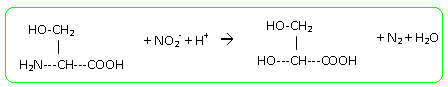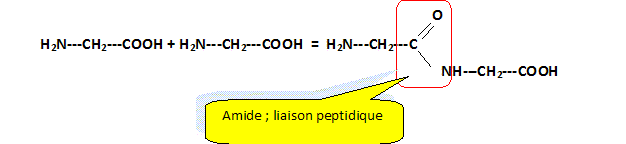|
Autour d'acide a-aminés naturels : sérine et glycine, synthèse de l'anthranilate de méthyle ( bac Stl chimie de laboratoire 2009) |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
La sérine a une masse molaire de 105 g/mol ; sa composition centésimale massique est : % C = 34,3 ; % H = 6,7 ; % O = 45,7 ; % N = 13,3. Montrer que la formule brute de la sérine est C3H7NO3. La formule brute est de la forme Cx Hy Oz Nt avec x, y, z et t entiers.
D'où x = 1,05*34,3 / 12 = 3 ; y = 1,05 *6,7 = 7 ; z = 1,05*45,7 / 16 = 3 ; t = 1,05*13,3 / 14 = 1. sachant que la sérine possède une fonction alcoolprimaire, en déduire sa formule semi-développée. Nommer la sérine selon la nomenclature officielle.
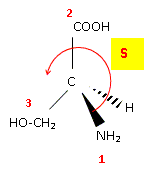
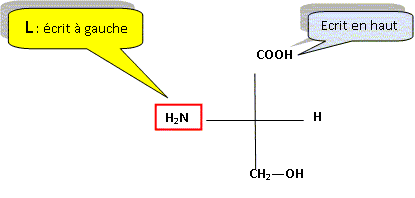
Dessiner un des énantiomères de la sérine en représentation de Cram puis déterminer sa configuration absolue en justifiant soigneusement.
numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. NH2 (1) ; COOH (2) ; CH2OH (3) ; H (4). On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S).
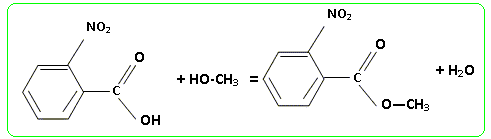
Ecrire l'équation de la réaction décrite et nommer le produit B obtenu.
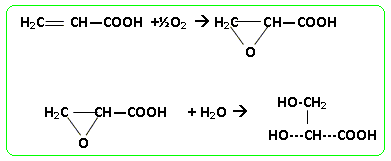
B : acide-2,3-dihydroxypropanoïque. Le composé B peut être également obtenu par l'époxydation de l'acide propènoïque, suivie de l'hydrolyse acide de l'époxyde obtenu. Donner la formule semi-développée de l'acide propènoïque. Ecrire la formule semi-développée de l'époxyde intermédiaire. Ecrire l'équation de la réaction d'hydrolyse de l'époxyde, conduisant à B.
La glycine. Le nom officiel de la glycine est : acide 2-aminoéthanoïque. Donner la formule semi-développée de ce composé, ainsi que sa formule brute. H2N-CH2-COOH ; formule brute : C2H5O2N. Préciser les propriétés acido-basiques des deux fonctions chimiques présentes dans la glycine. Donner la formule semi-développée de l'espèce prépondérante de la glycine en milieu très acide, puis en milieu très basique. La fonction amine -NH2 est une base ; la fonction acide carboxylique -COOH est un acide. En milieu très acide, la forme H3N+-CH2-COOH prédomine ; en milieu très basique, la forme H2N-CH2-COO- prédomine. La glycine peut réagir avec elle même pour donner un composé C, de formule brute C4H8N2O3. Ecrire l'équation de la réaction mise en jeu, en utilisant d'abord les formules brutes. Indiquer la formule semi-développée de C ainsi que le nom de la fonction chimique formée lors de cette réaction. C2H5O2N + C2H5O2N = C4H8N2O3 + H2O.
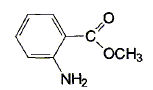
Synthèse de l'anthranilate de méthyle. L'anthranilate de méthyle est un pesticide servant de répulsif à oiseaux mais est également utilisé en parfumerie et dans l'industrie des arômes ( on retrouve la molécule dans les fleurs d'oranger, jasmin, acacia...). Sa formule
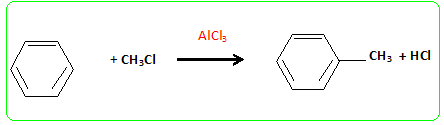
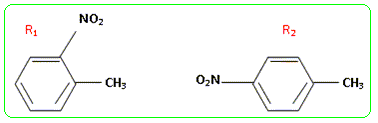
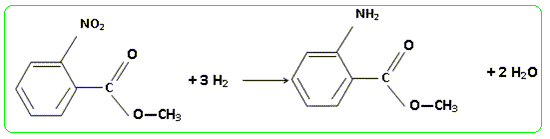
semi-développée est : Pour réaliser sa synthèse, on réalise une suite d'opération à partir du benzène : - réaction 1 : on prépare le toluène à partir du benzène et de chlorométhane - réaction 2 : le toluène est soumis à l'action du mélange sulfonitrique à froid pour conduire à deux composés R1 ( dérivé ortho ) et R2 ( isomère de R1) - réaction 3 : R1 est oxydé par les ions permanganate en milieu acide : on obtient le produit S - réaction 4 : S réagit avec un réactif approprié, en présence d'acide sulfurique, pour conduire au 2-nitrobenzoate de méthyle, composé T - réaction 5 : T est réduit par le dihydrogène en présence de carbonate de cuivre (II) ; on obtient alors l'anthranilate de méthyle. Obtention du toluène. Ecrire l'équation de la réaction en précisant les conditions opératoires. La réaction est une substitution : préciser si elle est nucléophile, électrophile ou radicalaire. Indiquer le nom de la réaction.
La réaction est une substitution électrophile du noyau benzénique : alkylation de Friedel et Craft en présence d'un catalyseur AlCl3. Nitration du toluène. Donner les formules semi-développées de R1 et R2. Indiquer la formule de l'espèce électrophile intervenant dans cette réaction. L'espèce électrophile est : +NO2 : cation nitryle.
Obtention de l'anthranilate de méthyle. Ecrire l'équation de la réaction 5.
Nommer l'anthranilate de méthyle suivant la nomenclature officielle. 2-aminobenzoate de méthyle.
|
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|
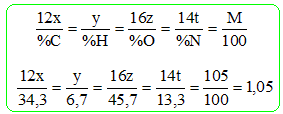
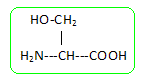 acide 2-amino-3 hydroxypropanoïque
acide 2-amino-3 hydroxypropanoïque