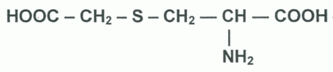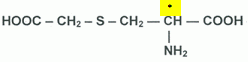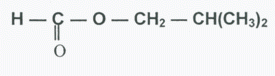|
Oxydoréduction: eau oxygénée ; marquage isotopique ; acide aminés, ester : bac physique chimie St2S Polynésie 2009. |
||||||||||||||||
|
||||||||||||||||
|
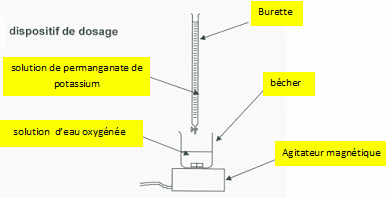
L'eau oxygénée vendue en pharmacie existe en différentes valeurs de dilution ( 10, 20 ou 30 volumes ). Seule la solution à 10 volumes peut être utilisée comme antiseptique et hémostatique. les solutions à 20 ou 30 volumes sont employées comme décolorants ou détachant, mais en aucun cas pour désinfecter une plaie. Ne mettez pas la solution en contact avec les yeux. Cet antiseptique ne convient pas pour la désinfection des ciseaux, rasoirs et autres objets potentiellement contaminants. De même, il ne doit pas être utilisé pour désinfecter la peau avant une piqure. Définir le terme souligé dans le texte. Un antiseptique est une substance qui détruit ou empèche la multiplication des bactéries et des virus à la surface externe du corps. Vous avez à la maison un flacon d"eau oxygénée à 20 volumes. Quelle est la précaution à prendre pour pouvoir l'utiliser pour nettoyer une plaie ? Il faut diluer deux fois la solution ( à 10 mL de solution ajouter 10 mL d'eau ). L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène de formule H2O2. A température ordinaire, le peroxyde d'hydrogène se décompose lentement selon une réaction d'équation : 2H2O2 ---> 2H2O + O2. Nommer les produits formés. H2O : eau et O2 : dioxygène. Vendue en pharmacie, l'eau oxygénée à 10 volumes a une concentration C voisine de 1 mol/L. On se propose de vérifier sa valeur en réalisant un dosage. La solution commerciale est d'abord diluée 20 fois. On appelle S1 la solution obtenue de concentration C1. Le volume de solution commerciale de concentration C1 à prélever pour préparer 100 mL de solution S1 est de 5 mL.Décrire brièvement le protocole en indiquant le matériel utilisé. Prélever 5 mL de solution commerciale à l'aide d'une pipette jaugée munie d'un pipeteur :  Verser dans une fiole jaugée de 100 mL :  Compléter jusqu'au trait de jauge avec de l'eau distillée ; boucher et agiter.
Les deux couples oxydant / réducteur utilisés dans ce dosage sont : O2 / H2O2 et MnO4- /Mn2+. On donne les demi-équations d'oxydoréduction : MnO4- + 8H+ + 5e- = Mn2+ + 4H2O (1) O2 + 2H+ + 2e- =H2O2 (2) A partir de ces deux demi-équations, recopier et compléter l'équation de la réaction du dosage donnée ci-dessous: MnO4- + ....H2O2 +.......H+ --> ..... +......+ ........ 2 fois (1) : 2MnO4- + 16H+ + 10e- = 2Mn2+ + 8H2O 5 fois (2) écrire en sens inverse : 5 H2O2 =5O2 + 10H+ + 10e- . Ajouter : 2MnO4- + 16H+ + 10e- + 5 H2O2 = 2Mn2+ + 8H2O +5O2 + 10H+ + 10e- . Simplifier : 2MnO4-
+ 6H+ + 5 H2O2 = 2Mn2+ + 8H2O
+5O2 . A partir de la réaction du dosage montrer que l'on peut écrire la relation suivante : C1V1 = 2,5 C2 Véq. A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès ; après l'équivalence, l'autre réactif est en excès. n(MnO4- ) = C2 Véq ; n(H2O2) = C1 V1 ;
En déduire que C1 =4,4 10-2 mol/L. C1 =5C2 Véq /(2V1) = 5 *2,0 10-2 *8,8 / 20 = 4,4 10-2 mol/L. En
déduire la concentration C de la solution commerciale. L'eau oxygénée achetée est-elle bien à 10 volumes ? T =11,2 c = 11,2 *0,88 =9,86 ~ 10 volumes. ( réponse : oui).
Marquage isotopique et imagerie médicale.
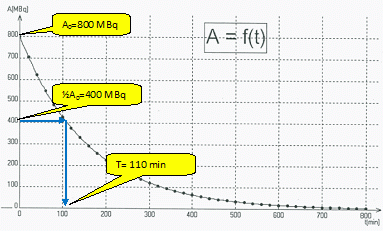
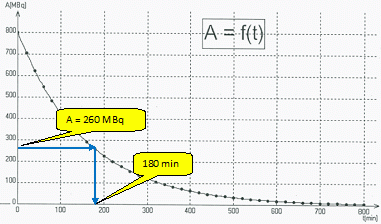
Le fluor 18 se désintègre spontanément pour donner un isotope de l'oxygène 18 ( 188O ). L'équation de cette désintégration nucléaire peut s'écrire : 189F ---> 188O + AZX. Donner le nom des différents constituants du noyau de l'isotope 18 du fluor. Les protons et les neutrons sont les constituants du noyau. En appliquant les lois de conservation, déterminer Z et A. Quelle est la particule émise ? En déduire le type de radioactivité. Conservation de la charge : 9 = 8+Z d'où Z = 1. Conservation du nombre de nucléons : 18 = 18 +A d'où A = 0. La particule émise est un positon 01e.
La radioactivité est de type ß+.
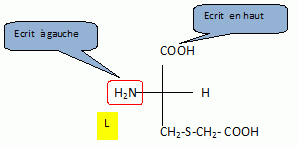
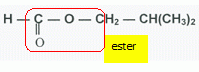
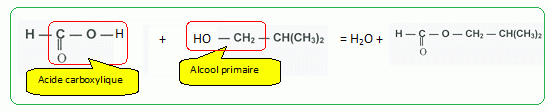
On veut synthétiser cette molécule au
laboratoire. A quelles familles
appartiennent ces deux réactifs ? |
||||||||||||||||
| |
||||||||||||||||
|
|