|
Elément chlore : réaction partielle ou totale ; datation d'une carotte glaciaire ( bac S Reunion 2009) |
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
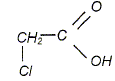
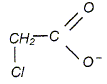
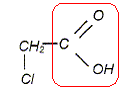
On cherche à comparer la réactivité de deux acides avec l'eau : l'acide monochloroéthanoïque et l'acide chlorhydrique.
On a préparé une solution S1 en dissolvant une masse m1 = 0,945 g d'acide monochloroéthanoïque dans l'eau. Le volume de solution, après dissolution totale, est égal à V1 = 1,00 L. Le pH de cette solution vaut pH1 = 2,5. On note c1 la concentration molaire en soluté apporté dans la solution S1. On a préparé une solution S2 d'acide chlorhydrique en dissolvant une quantité de matière n2 = 1,00 10-3 mol de chlorure d'hydrogène gazeux dans l'eau. Le volume de solution, après dissolution totale, est égal à V2 = 100 mL. Le pH de cette solution vaut pH1 = 2,0. On note c2 la concentration molaire en soluté apporté dans la solution S2. Donner la définition d'un acide au sens de Brönsted. Espèce, ion ou molécule, susceptible de céder un proton H+.
Quantité de matière d'acide monochloroéthanoïque : n1 = m1/M = 0,945 / 94,5 = 1,00 10-2 mol c1 = n1/V1 =1,00 10-2 / 1,00 = 1,00 10-2 mol/L. c2 = n2/V2 =1,00 10-3 / 0,100 = 1,00 10-2 mol/L. On modélise la transformation chimique, entre chacun des deux acides et l'eau par l'équation générale : AH aq + H2O(liq) = A-aq + H3O+aq. On considère une volume V de solution aqueuse d'un acide AH, de concentration molaire en soluté apporté c. On notera l'avancement x, l'avancement maximal xmax et l'avancement final xf. Compléter le tableau d'avancement de la réaction de l'acide AH avec l'eau. ( avec les valeurs littérales).
xf =n(H3O+aq) = [H3O+aq] V avec [H3O+aq] = 10-pH ; par suite : xf =10-pH V. Définir le taux d'avancement final noté t. Montrer que le taux d'avancement d'écrit : 10-pH / c. t = xf / xmax. xf =10-pH V ; xmax = cV d'où : t =10-pH / c. En déduire les valeurs t1 et t2 du taux d'avancement final de chacune des réactions associées aux transformations donnant les solutions S1 et S2. Conclure. t1 =10-pH1 / c = 10-2,5 / 1,00 10-2 = 10-0,5 =0,316 ~ 0,32. L'acide monochloroéthanoïque réagit partiellement avec l'eau (t1 < 1) t2 =10-pH2 / c = 10-2,0 / 1,00 10-2 =1,0. Le chlorure d'hydrogène réagit totalement avec l'eau (t1 = 1).
Le chlore possède plusieurs isotopes dont trois seulement existent à l'état naturel : le chlore 35 3517Cl, le chlore 37 3717Cl et le chlore 36 3617Cl. Les deux premiers sont stables alors que le chlore 36 est radioactif. Dans les eaux de surface ( mers, lacs) le chlore 36 est constamment renouvelé et la teneur en chlore 36 reste constante au cours du temps. Cette constatation permet de nous donner une référence. Dans la glace à plusieurs mètres sous la surface, le renouvellement n'existe plus et la proportion de chlore 36 par rapport à tous les noyaux de chlore présent initialement diminue au cours du temps. La connaissance du temps de demi-vie du chlore 36 ( t½ = 3,08 105 ans) et de sa teneur dans un échantillon de glace permet de dater celui-ci. On note N(t), le nombre de noyaux de chlore 36 présents à la date t. N0, le nombre de noyaux de chlore 36 présents initialement. l, la constante radioactive de cet élément. lt½ = ln 2. Donner la composition d'un noyau de chlore 36. 17 protons et 36-17 = 19 neutrons. Définir isotopes. Des isotopes ont le même nombre de charge Z, mais des nombres de neutrons différents. Définir noyau radioactif. Noyau instable qui par désintégration spontanée donne un noyau plus stable et une particule ( noyau d'hélium, électron, positon ...). La réaction de désintégration du chlore 36 donne un noyau d'argon stable de symbole 3618Ar. Donner l'équation de la désintégration d'un noyau de chlore 36 en indiquant les lois de conservation utilisées. 3617Cl---> 3618Ar + AZX. Conservation de la charge : 17 = 18 + Z d'où Z = -1. Conservation du nombre de nucléons : 36 = 36 +A d'où A =0 3617Cl---> 3618Ar + 0-1e. Donner le nom de la particule émise. électron. Donner l'expression de la loi de décroissance radioactive. N(t) = N0 exp(-l t).
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|