|
A propos de conservateurs ( bac S Polynésie 2009) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
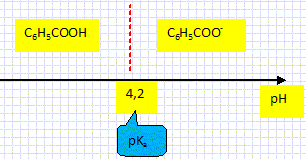
On donne : pKa ( C6H5 COOH aq /C6H5 COO- aq )= 4,2 à 25°C.
Espèce, ion ou molécule susceptible de céder un proton H+. Ecrire l'équation de la réaction entre l'acide benzoïque et l'eau. C6H5 COOH aq + H2O(l) = C6H5 COO- aq + H3O+aq. Déterminer le domaine de prédominance de chaque espèce du couple.
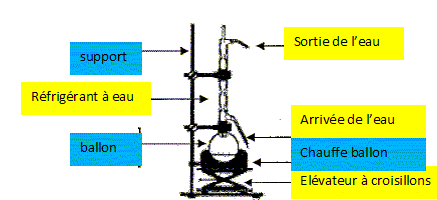
Mettre dans le ballon : 100 mL de solution aqueuse de soude à 0,40 mol/L ; 2,5 mL d'alcool benzylique ; 4,5 g de permanganate de potassium ; quelques grains de pierre ponce. Réaliser un chauffage à reflux et chauffer à ébullition douce pendant 30 min. Il apparaît un précipité marron de dioxyde de manganèse MnO2. L'équation de la réaction notée (1) s'écrit : 3 C6H5CH2OH aq + 4 MnO4- aq = 3 C6H5CO2- aq + 4 MnO2 (s)+ HO- aq + 4 H2O(l). Après refroidissement, filtrer le mélange à l'aide d'un filtre büchner : le filtrat obtenu est incolore. Verser le filtrat dans une ampoule à décanter, y ajouter environ 40 mL de cyclohexane, agiter et dégazer plusieurs fois, laisser reposer : on recueille la phase contenant le benzoate de sodium en solution. Annoter le schéma du montage à reflux.
Quel est l'intérêt d'un chauffage à reflux ? En travaillant à température modérée on accélère la réaction tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Quel composé recueille t-on dans le filtre du büchner ? Justifier. D'après (1) une seule espèce est solide MnO2. De plus l'ion benzoate est très soluble dans l'eau. Sur le filtre on recueille donc le dioxyde de manganèse.
n(alcool) = masse (g) / masse molaire (g/mol) avec masse(g) = volume (mL) * masse volumique ( g/mL) = 2,5 *1,05 =2,625 g n(alcool) = 2,625 / 108 = 2,43 10-2 ~ 2,4 10-2 mol. n( KMnO4) = m/M = 4,5 / 158 =2,848 10-2 ~ 2,8 10-2 mol. Compléter numériquement le tableau d'avancement et montrer que le réactif en excès est l'alcool.
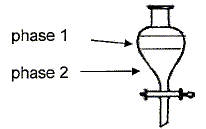
Si l'ion permanganate est en défaut : 2,8 10-2 -4xmax = 0 ; xmax = 2,8 10-2 /4 = 7,1 10-3. On retient la plus petite valeur : 7,1 10-3 ; l'alcool est en excès. Donner le nom des phases 1 et 2 en justifiant et leur composition.
La phase la plus dense ( l'eau d = 1) occupe la partie inférieure ; la phase la moins dense ( le cyclohexane d = 0,78) occupe la partie supérieure. L'alcool benzylique en excès est très soluble dans le cyclohexane. L'ion benzoate, l'ion hydroxyde, l'ion potassium, l'ion sodium sont très solubles dans l'eau.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|