Le chlorure d'hydroxylammonium de formule
NH3OHCl est un solide ionique blanc qui,
industriellement, est utilisé dans la synthèse
de colorants et de produits pharmaceutiques. Il est
très soluble dans l'eau. On se propose
d'étudier le caractère acide d'une solution
aqueuse S de chlorure d'hydroxylammonium
préparée au laboratoire.
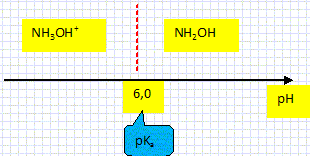
On donne : pKa (
NH3OH+aq /
NH2OH aq) = 6,0 à
25°C.
Ecrire l'équation de
dissolution du chlorure d'hydroxylammonium dans
l'eau.
NH3OHCl (s) =
NH3OH+aq +
Cl-aq.
Donner la définition d'un
acide selon Bronsted.
Espèce, ion ou molécule susceptible de
céder un proton H+.
Ecrire l'équation (1) de
la réaction entre l'ion hydroxylammonium et
l'eau.
NH3OH+aq +
H2O(l) = NH2OH aq +
H3O+aq.
(1)
Déterminer le domaine de
prédominance de chaque espèce du
couple.
Dosage de la solution S.
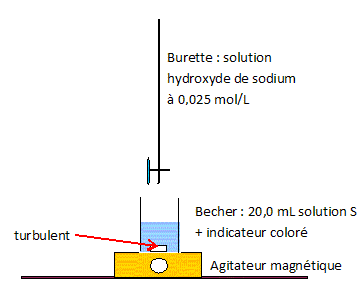
On dose un volume VA =
20,0 mL de la solution S par une solution aqueuse
d'hydroxyde de sodium Na+aq +
HO-aq de concentration molaire en
soluté apporté cB= 2,5
10-2 mol/L. On repère l'équivalence
à l'aide d'un indicateur coloré
acido-basique.
Faire un schéma
annoté du montage nécessaire à ce
dosage.
Ecrire l'équation (2) de
la réaction de dosage entre les ions hydroxylammonium
et les ions
hydroxyle.
NH3OH+aq
+ HO-aq =
NH2OH aq +H2O(l)
(2)
Définir
l'équivalence.
A l'équivalence les
quantités de matière de réactifs mis en
présence sont en proportions stoechiométriques
; avant l'équivalence l'un des réactif est en
excès, après l'équivalence, l'autre
réactif est en excès.
Le pH du mélange
à l'équivalence vaut 9,1.
Choisir l'indicateur
coloré dans la liste suivante et préciser le
changement de couleur à
l'équivalence.
|
|
teinte de la forme acide
|
teinte de la forme basique
|
zone de virage
|
|
hélianthine
|
rouge
|
jaune
|
3,1 - 4,4
|
|
rouge de méthyle
|
rouge
|
jaune
|
4,2 - 6,2
|
|
phénolphtaléine
|
incolore
|
rose
|
8,2 - 10,0
|
La zone de virage de l'indicateur coloré doit
contenir le pH du point équivalent : la
phénolphtaléine convient.
Dans le becher, avant l'équivalence, l'acide est
en excès ( solution incolore) ; après
l'équivalence, la soude est en excès et le pH
est supérieur à 9,1, donc teinte rose.
Le virage de l'indicateur coloré est obtenu
pour un volume versé de la solution aqueuse
d'hydroxyde de sodium Véq = 24,0
mL.
Calculer
CA.
Quantité de matière d 'acide :
CA VA ;
quantité de matière de base : CB
Véq ; à l'équivalence
CA VA = CB
Véq.
CA = CB Véq /
VA = 0,025 * 24,0 / 20,0 =
0,030 mol/L.
|
|
Le pH de la solution aqueuse S est 3,8.
En déduire la
concentration des ions oxonium dans cette
solution.
[H3O+]
= 10-pH = 10-3,8 1,585
10-4 ~
1,6 10-4
mol/L.
Etablir le tableau
d'avancement de la réaction
(1).
|
|
avancement (mol)
|
NH3OH+aq
|
+ H2O(l)
|
= NH2OH
aq
|
+
H3O+aq
|
|
initial
|
0
|
n0
|
solvant
|
0
|
0
|
|
état final
réel
|
xf
|
n0-xf
|
large excès
|
xf
|
xf
|
|
état final si
réaction totale
|
xmax
|
n0-xmax
|
xmax
|
xmax
|
Donner l'expression du taux d'avancement final
t en fonction de
n0 et nf(
H3O+) puis en fonction des
concentrations molaires CA et [
H3O+].Calculer sa valeur.
Cette réaction est-elle totale ?
t =
nf(
H3O+)
/
n0.
nf(
H3O+) =
[H3O]f
V avec V volume de la solution.
n0 =
CA V ; t
=[H3O]f
/
CA.
t
=1,6 10-4
/ 3,0 10-2 =
5,3
10-3.
t
est inférieur à 1 : la
réaction de l'ion hydroxylammonium avec
l'eau est limitée ; elle n'est pas
totale.
En déduire la
constante d'acidité Ka de la
réaction (1) puis la
calculer.
Ka = [NH2OH
aq]éq
[H3O+aq]éq
/
[NH3OH+aq]éq
[NH2OH
aq]éq
=[H3O+aq]éq
= xf /V avec V : volume de la
solution.
[NH2OH
aq]éq
=[H3O+aq]éq
= 1,6 10-4
mol/L.
[NH3OH+aq]éq
=(n0-xf) / V =
CA -
[H3O+aq]éq
=0,030 - 1,6
10-4= 2,984 10-2
mol/L.
Ka = (1,585
10-4)2 /
2,984 10-2 =
8,4
10-7.
En déduire la
valeur du pKa puis la comparer avec
celle donnée.
pKa = - log ( 8,4 10-7) = 6,07 ~
6,1.
écart relatif : ( 6,1-6) *100/ 6 = 1,7
%.
La valeur trouvée et la valeur
donnée sont identiques à 1,7 %
près.
|