|
Lactose : concours kiné 2009. |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
- Acide lactique : formule semi-développée : CH3 -CHOH-COOH ; masse molaire : 90,0 g.mol-1 ; - Le pKa du couple acido-basique de l'acide lactique est égal à 3,8. On notera HA l'acide lactique. L'acide lactique. Donner la formule semi-développée de l'ion lactate, base conjuguée de l'acide lactique. CH3 -CHOH-COO-. Donner l'expression de la constante d'acidité Ka du couple acide lactique / ion lactate. L'ion lactate est noté A-. AH + H2O = A- + H3O+. Ka = [A-][H3O+] / [AH] La mesure au laboratoire du pH d'une solution d'un litre d'acide lactique de concentration c égale à 1,0×10-2 mol.L-1 donne pH = 2,9. Calculer la concentration en ions oxonium dans la solution. [H3O+] = 10-pH = 10-2,9 = 1,26 10-3~ 1,3 10-3 mol/L. En remplissant le tableau d'avancement , calculer la valeur de la constante Ka du couple de l'acide lactique, puis celle de son pKa.
pKa = -log Ka = -log 1,8 10-4 =3,74 ~ 3,7. Quelle peut être la cause du léger écart observé avec la valeur donnée plus haut ? Les valeurs du pH et de la concentration sont données avec seulement deux chiffres significatifs. Une plus grande précision sur celles-ci devrait conduire à pKa = 3,8. Par exemple, un calcul fait à partir de pH = 2,94 conduit à pKa = 3,82.
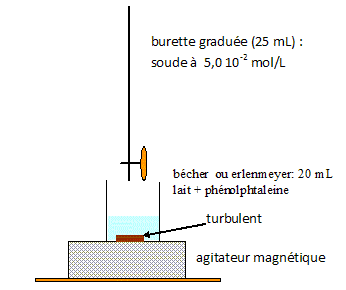
On introduit dans un erlenmeyer 20,0 mL d'un échantillon de lait et quelques gouttes de phénolphtaléine. On ajoute progressivement une solution d'hydroxyde de sodium de concentration 5,0×10-2 mol.L-1. Le changement de couleur du milieu réactionnel est observé pour un volume de solution d'hydroxyde de sodium ajouté égal à 9,2 mL. Faire le schéma annoté du montage expérimental.
|
|||||||||||||||||||||||||||||||
|
c |
|||||||||||||||||||||||||||||||
|
|