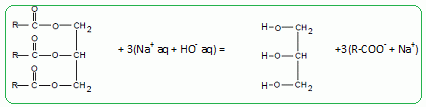Issu de traditions
millénaires, le monoï de Tahiti (produit cosmétique) vous assure de
bénéficier des vertus de la fleur de Tiaré et de l'huile de coprah
raffinée qui le composent ....
L'huile de coprah est très
riche en acides gras saturés (45 % d'acide laurique notamment).
Endémique en Polynésie
Française, la fleur de Tiaré présente des propriétés originales ....
Elle sécrète en effet une
huile essentielle riche en alcools et en esters (salicylate de méthyle
....) connus pour leurs propriétés assainissantes et apaisantes.
« d’après le site Internet de l'Institut
du Monoï »
Cet exercice a pour
objectif d’étudier une utilisation de l’huile de
coprah pour fabriquer du savon puis d’étudier quelques propriétés d’un
ester
présent dans la fleur de Tiaré.
.
nom
|
formule
|
masse
molaire (g / mol)
|
laurate
de glycéryle
|
C39H74O6
|
M1
=638
|
laurate
de sodium
|
C12H23O2Na |
M2
=222 |
glycérol
|
C3H8O3 |
M3
=92,0 |
L'huile
de coprah
Le
savon de Marseille est fabriqué avec des huiles végétales telles que
l'huile
d'arachide, l'huile de coprah – au grand pouvoir moussant – et l'huile
de
palme.
On lit sur le
site de la savonnerie "Le Sérail" : ″
La première étape de fabrication est le mélange des huiles
végétales avec l'alcali* auquel on va ajouter du sel de mer. La cuisson
consiste à porter à ébullition la pâte pendant quatre heures à une
température
d'environ cent degrés.″
* alcali :
nom générique d’une base. Exemples : soude
(hydroxyde de sodium) ou potasse (hydroxyde de potassium).
La
transformation chimique de
l'huile de coprah :
Quel est le nom
de la
réaction chimique citée ci-dessus, qui met en jeu une huile et l’alcali
?
Saponification ( hydrolyse basique) d'un ester.
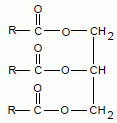
L'huile de
coprah est
constituée d'un mélange de triglycérides de formule générale :
Écrire l’équation de
la réaction entre
un triglycéride et l'hydroxyde de sodium en solution aqueuse (Na+ +
HO–).
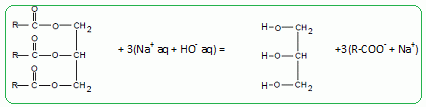
|
|
On considère pour la
suite que l'huile est constituée uniquement du laurate de glycéryle qui est un triglycéride de l'acide laurique.
L’acide laurique a pour formule CH3 –(CH2)10
–
COOH.
Donner la formule
semi-développée du savon
obtenu, le laurate de sodium, par action de la solution de soude sur le
laurate
de glycéryle.
CH3 –(CH2)10 – COO- + Na+.
|
Dans une
savonnerie, pour obtenir 1,0 tonne
de savon, on utilise une masse m1 = 1,3 tonne
(soit 1,3 x 10 3 kg) de
laurate de
glycéryle et un volume V0 = 2,0 m3 de
solution
d'hydroxyde de sodium de concentration c0 = 6,0 mol.L- 1. On note n1 la
quantité de matière initiale de laurate de glycéryle et n0
celle
d'hydroxyde de sodium.
Compléter le tableau
d'avancement
puis
calculer
les valeurs de n1 et de n0.
| équation |
|
C39H74O6 |
+3Na+ |
+3HO-
|
=3(C12H23O2-
+ Na+)
|
+C3H8O3
|
état du système
|
avancement (mol)
|
|
quantités
|
de |
matière
|
(mol) |
|
initial
|
0
|
n1
|
n0
|
n0
|
0
|
0
|
en cours
|
x
|
n1 -x
|
n0-3x |
n0-3x
|
3x
|
x
|
final
|
xmax
|
n1-xmax |
n0-3xmax |
n0-3xmax |
3xmax |
xmax |
n1 = m1 / M1
=1,3 x 10 6 /
638 =2,0376 103~2,0 103 mol.
V0 = 2,0 m3 =2,0 103
L ; n0 =V0 c0 =2,0
103 *6,0 = 1,2 104 mol
Montrer
que l'avancement maximal est xmax = 2,0 x10 3 mol.
Si le lauréate de glycéryle est en défaut : n1-xmax = 0 ; xmax = n1 = 2,0 103 mol.
Si l'hydroxyde de sodium est en défaut : n0-3xmax= 0 ; xmax = n0 /3 = 1,2 104/3=4,0 103 mol.
On retient la plus petite valeur xmax =2,0
103 mol.
En déduire la masse
maximale m2 de laurate de
sodium attendue.
m2 =
3 xmax M2
=3*2,0 103 *222 =1,332 106 g = 1,3 t.
Définir le rendement
de la
synthèse du savon puis le calculer.
Rendement = masse réelle / masse théorique maximale =1,0 / 1,332
=0,75 ( 75 %).
Propriétés du
laurate de sodium.
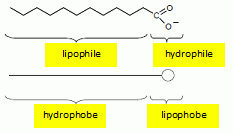
On
peut représenter schématiquement l’ion actif du savon de la façon
suivante :
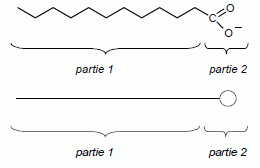
Reproduire le schéma
simplifié et légender
chaque partie à l'aide du vocabulaire suivant : hydrophile, hydrophobe,
lipophile, lipophobe.
Choisir en justifiant parmi les schémas
1.a et 1.b
de la figure 1 celui qui peut
expliquer le mode d'action d'un savon.
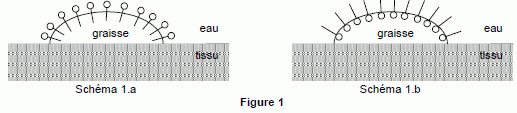
La partie lipophyle du savon se fixe sur la graisse ;
la partie hydrophile du savon se fixe dans l'eau. Après agitation la
graisse se détache du tissu et est entraînée dans l'eau : figure 1.
Salicylate de méthyle issu de la
fleur de Tiaré.
Le
salicylate de méthyle, présent dans la fleur de Tiaré, est un composé
moléculaire pouvant subir différentes réactions de décomposition ou de
dégradation dont deux d'entre elles sont étudiées ci-après.
Sa formule semi-développée est :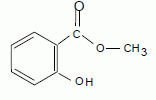
nom
|
formule
|
température
d'ébullition ( sous 1 bar)
|
acide
salicylique
|
HO-C6H4-COOH
|
q1=211°C
|
méthanol
|
CH3OH
|
q2=65°C |
salicylate
de méthyle
|
HO-C6H4-COOCH3 |
q3=223°C |
Réaction d'hydrolyse du salicylate
de méthyle.
Recopier la formule,
entourer et nommer les groupes caractéristiques de la molécule.
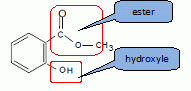
En 1844, Auguste Cahours
réalise l'hydrolyse du salicylate de méthyle, accédant ainsi à l'acide
salicylique qui fut employé comme médicament contre les rhumatismes
avant la
synthèse de l'aspirine. L’équation de cette
réaction
est :
HO-C6H4-COOCH3
+ H2O
= HO-C6H4-COOH + CH3OH
Citer une propriété
caractéristique de
cette réaction.
L'hydrolyse d'un ester est lente et limitée par l'estérification. Elle
conduit à un équilibre chimique.
Citer un procédé
permettant d’augmenter
la vitesse de réaction.
Travailler à température plus élevée ; utiliser un
catalyseur.
Citer un procédé
permettant d’obtenir davantage de produit
par déplacement d’équilibre.
Utiliser un réactif en excès ; éliminer l'un des
produits au fur et à mesure su'il se forme ( dans ce cas,
la distillation élimine le méthanol, pour lequel la température
d'ébullition est faible).
|
|
Dégradation
photochimique du salicylate de méthyle.
Comme
nombre de composés moléculaires organiques, le salicylate de méthyle se
dégrade
sous l'action de la lumière. On étudie par spectrophotométrie la
cinétique de
sa décomposition.
Pour
cela, on soumet des films contenant du salicylate de méthyle à un
rayonnement
de longueurs d’onde comprises entre 280 et 350 nm, à une température de
60°C.
La puissance ainsi reçue
par unité de surface du film est égale à environ 6 fois celle qui
correspond à
une irradiation solaire maximale.
2.2.1. La courbe donnant l'évolution
de l'absorbance du film contenant du salicylate de méthyle en fonction
de la
longueur d’onde est représentée sur la figure
2 avant irradiation et après quelques heures d’irradiation :
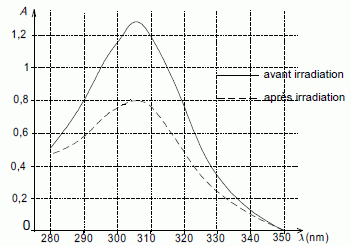
Quelle est la
longueur
d'onde optimale pour l'étude de l'absorbance du film ? Justifier.
On choisit la longueur d'onde correspondant au maximum d'absorption ;
dans ce cas 305 nm.
Dans quel domaine du
spectre électromagnétique (ultraviolet, visible, infrarouge) cette
longueur
d’onde se situe-t-elle ?
Le domaine du
spectre visibble s'étend de 400 nm à 800 nm ; la longueur d'onde l = 305 nm appartient au
domaine UV.
D’après
la figure 2, comment expliquer
la
différence d’absorbance du film contenant du salicylate de méthyle,
avant et
après irradiation ?
Une partie du salicylate de méthyle s'est dégradé sous l'action de la
lumière.
Pour l’étude
cinétique,
on expose les films à l’irradiation pendant des durées déterminées,
puis on
mesure l'absorbance du film pour une longueur d’onde de 306 nm.
Dans les conditions de
l’expérience,
l’absorbance étant proportionnelle à la quantité de matière de
salicylate de
méthyle restant, on obtient la courbe d’évolution temporelle de
l’avancement x
de la réaction de dégradation donnée ci-dessous.
L’étude
cinétique montre que la
dégradation du salicylate de méthyle est lente. Dans
cette étude, la vitesse peut s'écrire :
 |