|
Le synthol : acide base, titrage, conductimétrie ( bac S France 2009) |
||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
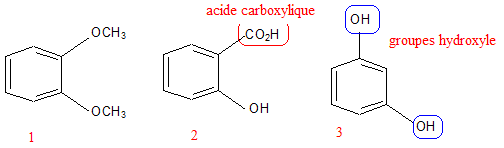
Pour 100 g de solution, la composition en substance active est : Levomenthol : 0,2600 g ; Vératrole : 0,2600 g ; Résorcinol : 0,0210 g ; Acide salicylique : 0,0105 g. Les autres composants sont l'huile essentielle de géranium, l'huile essentielle de cédrat, le jaune de quinoléine (E104). Toutes les espèces chimiques présentes dans le Synthol sont solubilisées dans un solvant à base d'éthanol à 96% et d'eau purifiée (titre alcoolique 34,5% en volume). Après une étude de quelques composés du Synthol, on vérifiera par un dosage la teneur en acide salicylique de la solution commerciale. Quelques composés du Synthol. On veut identifier les formules de l'acide salicylique, du résorcinol et du vératrole qui entrent dans la composition du Synthol. Sachant que l'acide salicylique est un acide carboxylique et que le résorcinol possède deux groupements hydroxyle, identifier les trois molécules en leur attribuant leur numéro.
2 : acide salycilique ; 3 : résorcinol ; par déduction 1 : vératrole. Etude de l'acidité d'une solution d'acide salicylique. On note AH la molécule d'acide salicylique. On introduit une quantité de matière n0 = 7,20 10-4 mol de l'acide AH dans un volume V0 = 100,0 mL d'eau distillée de façon à obtenir une solution de concentration c0. Après agitation la valeur du pH mesuré est 2,6. Ecrire l'équation de la réaction de l'acide avec l'eau. AH (aq) + H2O (l) = A-(aq) + H3O+(aq). Construire le tableau descriptif de l'évolution du système et le compléter en utilisant des expressions littérales.
[ H3O+(aq)] = 10-pH = xéq / V0 ; xéq = V0 10-pH. Pour la solution préparée, calculer l'avancement à l'équilibre xéq. xéq = 0,100* 10-2,6 = 2,512 10-4 ~ 2,5 10-4 mol. Définir le taux d'avancement à l'équilibre. Calculer sa valeur. La transformation est-elle totale ? t = xéq / xmax = xéq /n0 = 2,512 10-4 / 7,20 10-4 =0,3488 ~ 0,35. Cette valeur étant inférieure à 1, la réaction n'est pas totale. Formule brute de l'acide
salicylique :
C7H6O3
; Masse molaire de l'acide
salicylique : MA = 138 g/mol.
Masse volumique de la
solution pharmaceutique : r
= 0,950 g/mL. On admet que l'acide
salicylique est le seul composé acide dans
la solution pharmaceutique.
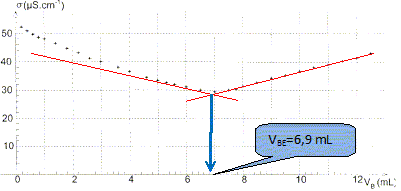
A l'aide des informations fournies sur la notice et des données ci-dessus, calculer la quantité de matière d'acide salicylique contenu dans un volume VA = 100,0 mL de Synthol. Masse de 100 mL de solution : VAr = 100 * 0,950 = 95,0 g. Pour 100 g de solution, la composition en substance active est : Acide salicylique : 0,0105 g. D'où la masse d'acide salycilique dans 95,0 g de solution : mA = 0,015*95/100 =9,975 10-3 g Quantité de matière d'acide salycilique : nA = mA /MA = 9,975 10-3 / 138 =7,228 10-5 ~ 7,23 10-5 mol. Vérifier que sa concentration est cA = 7,23 10-4 mol/L. concentration (mol/L) = quantité de matière (mol) / volume de la solution (L) cA =nA / VA = 7,23 10-5 / 0,100 = 7,23 10-4 mol/L. Préparation du dosage. Pour vérifier cette valeur, on souhaite effectuer un dosage acido-basique avec une solution d'hydroxyde de sodium (Na++ HO-). Le volume de Synthol dosé est VA = 100,0 mL. On admet que les calculs de concentration se conduisent pour la solution pharmaceutique de la même manière qu'en solution aqueuse. On écrit l'équation de la réaction support du dosage de la manière suivante : C7H6O3 + HO- = C7H5O3 - + H2O Après avoir donné la définition de l'équivalence, écrire la relation entre la quantité de matière d'acide salicylique ni(C7H6O3) et la quantité de matière d'ions hydroxyde n(HO-), qui permet d'atteindre cette équivalence. A l'équivalence les réactifs sont en proportions stoechiométriques ; avant l'équivalence, l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès. ni(C7H6O3) = cA VA ; n(HO-) = cB VB E avec cB concentration de l'hydroxyde de sodium et VB E volume d'hydroxyde de sodium ajouté à l'équivalence. cA VA = cB VB E On souhaite obtenir un volume équivalent VBE compris entre 5,0 mL et 20,0 mL. Donner un encadrement de la concentration de la solution d'hydroxyde de sodium à utiliser. cB = cA VA/VB E = 7,23 10-4 *100 / VB E = 7,23 10-2 / VB E. c B max = 7,23 10-2 / 5,0 = 1,446 10-2 ~1,4 10-2 mol/L. c B min = 7,23 10-2 / 20,0 = 3,615 10-2 ~3,61 10-3 mol/L. Au laboratoire on ne dispose que d'une solution S0 d'hydroxyde de sodium de concentration c0 = 0,10 mol/L En justifiant, décrire le protocole pour fabriquer à partir de S0, un volume de 50,0 mL d'une solution de concentration cB = 1,0 10-2 mol/L. On précisera la verrerie utilisée. Facteur de dilution F = concentration de la solution mère divisée par la concentration de la solution fille. F = c0 / cB= 0,10 / =0,010 = 10. Volume de la pipette jaugée
= volume de la fiole jaugée / F = 50,0 / 10 = 5,0
mL. Placer dans la fiole jaugée de 50,0 mL et compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène.
Dosage colorimétrique. Grâce à un logiciel de simulation, on détermine que le pH à l'équivalence lors du dosage est d'environ 7. Choisir, en le justifiant,
l'indicateur coloré approprié pour le dosage,
dans la liste ci-dessous.
Le bleu de bromothymol convient. Quel composé, entrant dans la composition du Synthol, peut empêcher de bien observer le changement de couleur de l'indicateur coloré ? Justifier. Le jaune de quinoléine (E104) va géner l'observation du changement de couleur ( jaune au bleu) à l'équivalence.
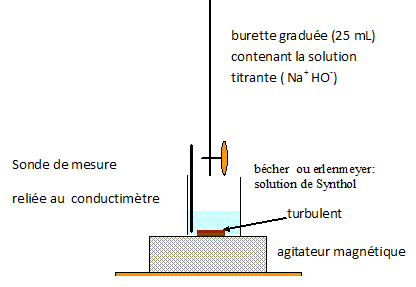
Dosage suivi à l'aide d'un pH-mètre. Les électrodes pH-métriques utilisées en terminale sont adaptées uniquement à des mesures en solution aqueuse. D'après le texte introductif, quelle espèce chimique présente en quantité relativement importante dans le Synthol ne permet pas de recommander un dosage pH-métrique ? "le Synthol est une solution alcoolisée" : l'alcool éthylique, 35 % en volume.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|