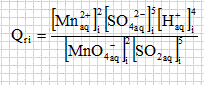|
Titrage du dioxyde de soufre présent dans un échantillon d'air ( bac S Asie 2009) |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
Le dioxyde de soufre SO2 est un gaz qui a des propriétés réductrices et qui est présent dans l'air pollué. Quand on fait barboter un grand volume d'air dans un litre d'eau, le dioxyde de soufre va se dissoudre dans l'eau. Il est possible par la suite, de le titrer à l'aide d'une solution de permanganate de potassium, lors d'une réaction 'oxydo-réduction. La concentration massique du dioxyde de soufre dans l'air pollué est ainsi déduite de ce titrage. On a défini un seuil d'alerte de la population pour une teneur en dioxyde de soufre mesurée supérieure à 500 µg par m3. Protocole expérimental. Une solution S est préparée en faisant barboter 1,00 104 m3 d'air pollué dans V0 = 1,00 L d'eau. Un volume V1 = 10,0 mL de cette solution est placé dans un bécher de 100 mL. La solution violette de permanganate de potassium de concentration c = 1,00 10-2 mol/L est ensuite versée goutte à goutte jusqu'à persistance de la coloration. On donne : MS =32,0 g/mol ; MO =16,0 g/mol.. Quelle verrerie choisiriez-vous pour prélever avec précision 0,0 mL de solution S ? Pipette jaugée de 10,0 mL. Sachant que ls couples oxydant / réducteur mis en jeu sont : SO42-aq / SO2 aq et MnO4-aq / Mn2+ aq , en déduire que l'équation de la réaction entre les ions permanganate et le dioxyde de soufre est : 2MnO4-aq + 5SO2 aq + 2H2O(l) = 4H+ aq + 2 Mn2+ aq + 5 SO42-aq. Réduction de l'ion permanganate : 2 fois { MnO4-aq +8H+ aq +5e- = Mn2+ aq +4 H2O(l)} Oxydation de SO2 : 5 fois { SO2 aq + 2H2O(l) = SO42-aq + 2e- + 4H+ aq} Puis additionner les deux demi-équations : 2MnO4-aq +16H+ aq +10e- +5 SO2 aq + 10H2O(l) = 2Mn2+ aq + 8 H2O(l) +5 SO42-aq + 10e- + 20H+ aq Simplifier : 2MnO4-aq +16H+ aq +5 SO2 aq + 10H2O(l) = 2Mn2+ aq + 8 H2O(l) +5 SO42-aq + 20H+ aq 2MnO4-aq +5 SO2 aq + 2H2O(l) = 2Mn2+ aq +5 SO42-aq +4H+ aq Définir l'équivalence d'un titrage. A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques ; avant l'équivalence, l'un des réactifs est en excès, après l'équivalence, l'autre réactif est en excès. Cette transformation évoluant
spontanément dans le sens direct de la
réaction, comparer Q r
i à la constante d'équilibre K
associée. Le critère d'évolution
spontanée prévoit une
évolution dans le sens direct si
Q r i est
inférieur à
K. Tableau d'avancement :
Quantité de matière de dioxyde de soufre dans la prise : n1 = c1V1 ; Quantité de matière d'ion permanganate à l'équivalence : n2 = cVéq ; n1 = 2,5 n2 ; c1V1 =2,5 cVéq ; c1= 2,5 c Véq / V1 = 2,5 * 1,00 10-2*8,0 / 10,0 = 2,0 10-2 mol/L.
|
|||||||||||||||||||||||||||||||||||||||
|
|