L'argenture
est un procédé encore très utilisé qui consiste à déposer une fine
couche d'argent sur un métal moins noble, par exemple du cuivre pour la
fabrication de bagues bon marché. Le protocole consiste à réaliser une
électrolyse en utilisant une solution aqueuse de nitrate d'argent (Ag+(aq),
NO3-
(aq) afin de déposer sur cette bague en cuivre de l'argent sous forme
solide. Le volume de la solution S de nitrate d'argent introduite dans
l'électrolyseur sera V = 500 mL et sa concentration en soluté apporté C
= 4,00 x10-3 mol/L. Lla bague en cuivre, préalablement
décapée, est complètement immergée dans la solution et reliée par un
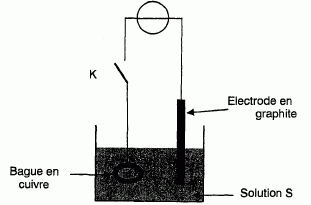
fil conducteur à un générateur comme le décrit le schéma ci-dessous.
Une électrode de graphite (considéré comme inerte) plongée dans la
solution, permet la circulation d'un courant électrique. L'électrolyse
commence lors de la fermeture de
l'interrupteur K. le générateur délivre alors pendant une durée notée Dt
un courant électrique d'intensité I constante.
Au niveau de l'électrode de graphite, on observe un dégagement gazeux
et sur l'électrode constituée par la bague, seul un dépôt d'argent
apparaît
distinctement. On considérera que les anions nitrate NO3-
(aq) ne subissent aucune
transformation chimique au cours de l'électrolyse. Ils contribuent
seulement au passage du courant électrique dans l'électrolyseur.
|
|
Données
:
Couple oxydo-réducteur : Ag+(aq)/Ag(s) ; H+(aq)/H2(g)
; 02(g)/H20(l)
Constante de Faraday F= 96500 C.mol-1.
Masses molaires en g.mol-1 :
M(Ag) = 107,9 M(H) = 1,0 M(O) = 16,0
.
|
Bilan de
l'électrolyse
La
bague en cuivre constitue-t-elle l'anode ou la cathode pour cette
électrolyse? Justifier votre réponse.
Doit-elle
être reliée à la borne positive ou négative du générateur de tension
présent dans le montage ?
Un dépôt
d'argent doit être réalisé sur la bague en cuivre. Les ions argent Ag+(aq)
sont rtéduit en argent métallique.
Une
réduction se déroule à la cathode de l'électrolyseur.
Une réduction nécessite un apport d'électrons : la bague doit donc être
reliée à la borne négative du générateur.
Quelle
autre demi-équation d'oxydoréduction est susceptible de se produire à
l'électrode constituée par la bague en cuivre ?
Les ions H+(aq)
peuvent être réduits en dihydrogène à la cathode.
Écrire
la demi-équation d'oxydoréduction susceptible de se produire à
l'électrode de graphite.
Les ions nitrate ne
participant pas à l'électrolyse, les molécules d'eau peuvent être
oxydées en dioxygène à l'anode positive.
2 H20(l) = 02(g)
+ 4H+(aq) + 4 e-.
À l'aide des
questions précédentes, justifier l'équation suivante traduisant le
bilan de l'électrolyse :
4Ag+(aq) + 2H20(l) = 4Ag(s) + 02(g) +
4H+(aq)
Réduction des ions
argent : 4Ag+(aq)
+ 4 e-= 4 Ag(s)
2 H20(l) = 02(g)
+ 4H+(aq) + 4 e-.
Ajouter ces deux demi-équations :
4Ag+(aq) +
4 e-+ 2 H20(l)= 4 Ag(s) +02(g)
+ 4H+(aq) + 4 e-.
Simplifier : 4Ag+(aq) +
2H20(l) = 4Ag(s) + 02(g) + 4H+(aq)
La durée de
l'électrolyse est de Dt = 80
min et l'intensité du courant vaut I= 24 mA
Déterminer la
quantité n(e-) d'électrons
échangée pendant cette durée.
Quantité d'électricité Q = I Dt = avec Dt = = 80*60 =4800 s et I = 0,024 A
Q = 4800*0,024 =115,2 C
Puis diviser par 96 500 : n(e-) =115,2 / 96500 =1,194 10-3 ~ 1,2 10-3 mol.
Déterminer la
quantité initiale d'ions Ag+, n(Ag+),présents à la
fermeture de l'interrupteur.
n(Ag+) = C V =4,00 x10-3 *0,500 =2,00 x10-3 mol.
Compléter le tableau
d'avancement.
| équation |
|
4Ag+(aq) |
+ 2H20(l) |
= 4Ag(s)
|
+ 02(g)
|
+ 4H+(aq)
|
|
état du système
|
avancement (mol)
|
|
quantités
|
de |
matière
|
(mol) |
n(e-)
échangés
|
|
initial
|
0
|
2,00 10-3
|
excès
|
0
|
0
|
excès |
0
|
en
cours
|
x
|
2,00 10-3 -4x
|
excès |
4x
|
x
|
excès |
4x =1,2 10-3 |
En déduire
l'avancement x de la réaction au bout de la durée de fonctionnement Dt.
Ag+(aq) + e-=
Ag(s)
D'après les nombres stoechiométriques de cette demi-équation : n(e-)
= n(Ag+) = 4x = 1,2 10-3 ;
x = 1,2 10-3
/ 4 = 3,0 10-4 mol.
Déterminer
la masse d'argent m(Ag) déposée sur la bague en cuivre.
m = n M = 4x
M(Ag) = 1,2 10-3 * 108 = 0,13 g.
Choix
d'une réaction support pour doser les ions argent restant après
électrolyse.
Dans un tube à essais contenant un volume V= 5,0 mL de solution de
nitrate d'argent (Ag+(aq),
NO3-
(aq) de concentration en soluté apporté C
= 4,00 x10-3 mol/L , on ajoute un volume V1= 1,0 mL de solution aqueuse de chlorure de sodium (Na+(aq) +
Cl-(aq)) de concentration en soluté apporté C1 = 1,00 x 10-1 mol/L. On observe la formation d'un précipité
blanc de chlorure d'argent AgCI(s).
Écrire l'équation de la réaction chimique ayant lieu dans le tube
à essais.
Ag+(aq) + Cl-(aq) = AgCl(s).
Exprimer littéralement le quotient de réaction Qr pour la réaction
ainsi écrite.
Qr = 1 / ([Ag+(aq)] [Cl-(aq)]).
Calculer le quotient de réaction Qr,i dans l'état initial où les
réactifs seraient mélangés sans avoir commencé à réagir.
Qr i = 1 / ([Ag+(aq)]i [Cl-(aq)]i) ; [Ag+(aq)]i = CV /(V+V1) =4,00 x10-3 x 5 /6 =3,33 10-3 mol/L.
[Cl-(aq)]i) = C1V1 /(V+V1) =1,00 x10-1 x 1 /6 =1,67 10-2 mol/L.
1 / (3,33,00 x10-3 x1,67 x 10-2 ) =1 / 4,00 10-4 =1,80 104.
Sachant que la valeur de la constante d'équilibre à 25°C est de K
= 6,4x109 , déterminer le sens d'évolution du système chimique (Justifier votre réponse). Votre
résultat est-il en accord avec l'observation faite dans le tube à essais? Justifier votre réponse.
Qr i
< K, le système évolue spontanément dans le sens direct, c'est
à dire formation du solide blanc, le chlorure d'argent. C'est en accord
avec l'observation expérimentale.
|
|
Détermination de la masse d'argent déposée sur la bague en cuivre.
On propose de vérifier la valeur de la masse d'argent déposée sur la bague électrolysée en utilisant
comme réaction support de dosage celle qui a été déterminée ci-dessus. On réalise alors un
titrage par conductimétrie en récupérant toute la solution S de nitrate d'argent contenue dans
l'électrolyseur que l'on place dans un récipient adapté. Cette solution a un volume V = 500 mL (on
admet que ce volume n'a pas varié après les diverses réactions aux électrodes). On mesure la
conductivité du mélange après chaque ajout de la solution titrante de chlorure de sodium de
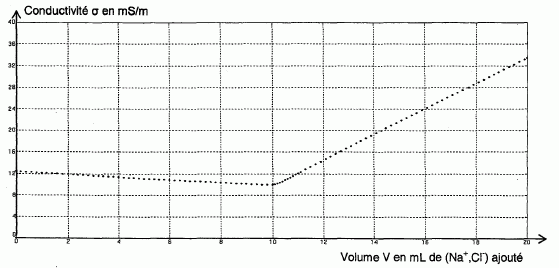
concentration en soluté apporté C1 = 1,00 x 10-1 mol/L. On obtient la courbe ci-dessous :
Pendant le titrage, on négligera les variations de volume du mélange.
Parmi la liste de matériel proposé, cocher celui nécessaire à la réalisation du titrage décrit ci-dessus.
Matériel proposé
|
Matériel nécessaire pour le dosage
|
Burette de 25 mL
|
x
|
Becher de 1,0 L
|
x |
becher de 250 mL
|
|
becher de 50 mL
|
x |
conductimètre avec sonde
|
x |
pHmètre avec son électrode
|
|
agitateur magnétique
|
x |
barreau aimanté
|
x |
éprouvette graduée de 25 mL
|
|
éprouvette graduée de 100 mL
|
|
pipette graduée de 10,0 mL
|
|
| pipette graduée de 25,0 mL |
|
|
Définir l'équivalence lors de ce titrage.
A l'équivalence les quantités de matière mis en présence sont en
proportions stoechiométriques ; avant l'équivalence l'un des réactifs
est en excès, après l'équivalence l'autre réactif est en excès.
Déterminer, à l'aide de la courbe ci-dessus, le volume noté VE de la solution de chlorure de sodium versée à l'équivalence.
L'intersection des deux segments de droite donne VE = 10 mL.
Exprimer la quantité de matière des ions argent restants nr(Ag+)dans la solution S en fonction de C1 et VE.
nr(Ag+) = quantité de matière d'ion chlorure ajoutés à l'équivalence.
nr(Ag+) =C1 VE.
Exprimer la quantité de matière d'ions argent nC(Ag+) consommés lors de l'électrolyse en fonction de C1,VE et ni(Ag+). Calculer nC(Ag+).
nC(Ag+) = ni(Ag+)-C1VE =2,00 x10-3 -1,00 10-1 *10 10-3 = 1,0 x10-3 mol.
En déduire que la masse d'argent m(Ag) déposé sur la bague en cuivre est de 0,11 g.
m = nC(Ag+) MAg= 1,0 10-3 *108 =0,108 ~0,11 g.
Votre réponse est-elle cohérente avec celle donnée ci-dessus ? Proposer une explication permettant de justifier l'écart possible.
La valeur expérimentale est inférieure à la valeur trouvée
ci-dessus ( 0,13 g). Des molécules d'eau sont réduites à la
cathode ; cette réaction concurence la réduction des ions argent.