|
Le parfum de pomme estérification, dosage ( bac S Afrique 2009) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
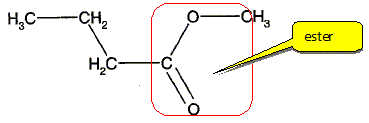
Entourer puis nommer la fonction chimique présente dans cette molécule.
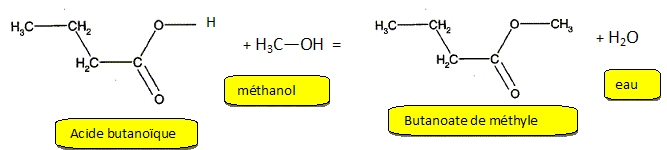
Le butanoate de méthyle est obtenu en faisant réagir deux espèces chimiques A et B. Le réactif B est un acide carboxylique. Quelle est la famille du réactif A ? A est un alcool, le méthanol . Donner les formules semi développées ainsi que les noms des réactifs A et B. En déduire l'équation de la réaction chimique modélisant cette synthèse.
Quel est le nom de cette synthèse chimique ? Estérification. Dans cette partie, l'équation de la
réaction modélisant la transformation
chimique sera écrite sous la forme : A(l) + B(l) = C(l) + H2O(l)
où C est le butanoate de méthyle. A l'instant initial, on mélange une
quantité n0, A = 1,0 mol du
réactif A avec une quantité n0,
B = 1,0 mol de réactif B. Le milieu
réactionnel est maintenu à
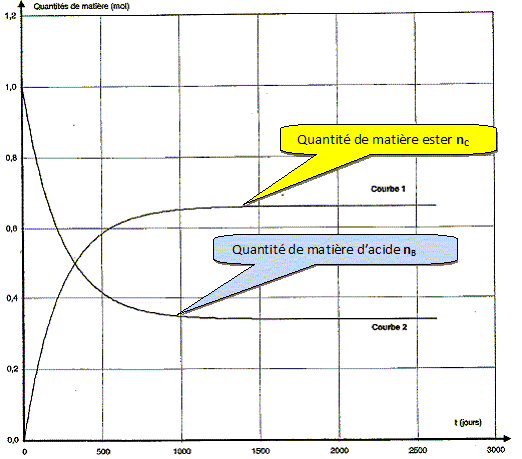
25°C. nC = x ; nB = n0, B -x par suite : nB = n0, B -nC d'où nC = n0, B -nB. Compléter le tableau
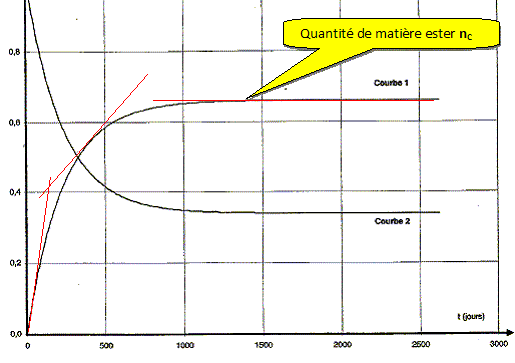
suivant : Identifier la courbe représentant l'évolution de la quantité de matière d'acide carboxylique au cours du temps et la courbe représentant la quantité de matière de butanoate de méthyle.
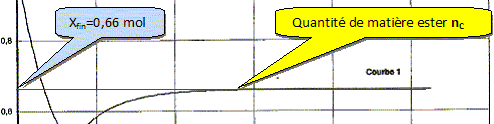
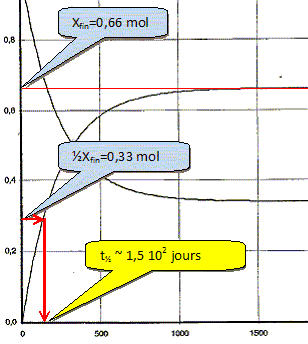
t = xfin / xmax ; avec n0, B -xmax =0 ; xmax = n0, B = 1,0 mol.
t = 0,66 / 1,0 = 0,66. La vitesse volumique est donnée par la relation v = 1/Vtot dx/dt où Vtot est le volume du mélange réactionnel et x l'avancement. Etablir l'expression de v en fonction de Vtot et nC. nC=x ; dx/dt = dnC/dt d'où v = 1/Vtot dnC/dt. A l'aide de l'une des deux courbes, expliquer comment évolue cette vitesse volumique au cours du temps Justifier.
dx / dt représente le coefficient directeur des tangentes à la courbe 1. Or ces tangentes sont de moins en moins inclinées par rapport à l'horizontale : le coefficient directeur de ces tangentes diminue au cours du temps. La vitesse volumique de la réaction étant proportionnelle à dx/dt et Vtot étant constant , la vitesse diminue au cours du temps. Définir puis déterminer la valeur du temps de demi-réaction t½. t½ : durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
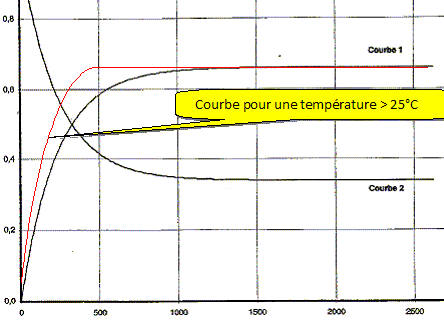
A température ambiante, la réaction précédente peut durer plusieurs mois, durée rendant cette synthèse inintéressante pour une pllication industrielle. Sans changer la nature des réactifs, proposer une méthode pour écourter la durée de la synthèse. Tracer l'allure de la courbe de la quantité de matière nC en fonction du temps qui sera alors obtenue. Travailler à température plus élevée et utiliser un catalyseur.
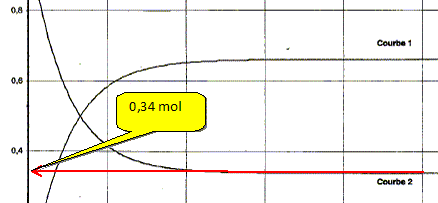
L'acide carboxylique sera, dans cette partie, noté AH. A la fin de la réaction on désire connaître la quantité d'acide carboxylique restant dans le milieu réactionnel. Pour cela on prélève un volume V de la solution qui correspond au dixième du volume total. On notera n0(AH) la quantité de matière d'acide contenue dans le prélèvement. La solution titrante est une solution aqueuse d'hydroxyde de sodium Na+aq + HO-aq de concentration cb = 2,0 mol/L. Le volume versé à l'équivalence est de VE= 17,0 mL. Ecrire l'équation de la réaction qui a lieu lors du dosage. AHaq + HO-aq = A-aq + H2O(l) Donner la définition de l'équivalence. A l'équivalence les quantités de matière de réactifs mis en présence sont en proportions stoechiométriques ; avant l'équivalence l'un des réactif est en excès, après l'équivalence, l'autre réactif est en excès.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|