|
calculs de pH ; solution tampon ; diagramme de Flood |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
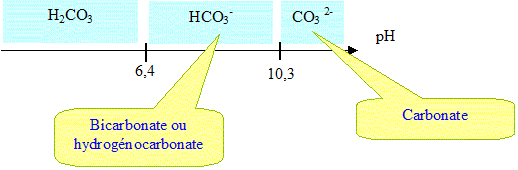
S1 : H2CO3 ; S2 : HCO3 - ; S3 : CO3 2- ; S4 : HCl. pKa1 (H2CO3/HCO3 - )= 6,4 ; pKa2 (HCO3 -/CO3 2-) = 10,3. Trouver les pH des solutions : S4 : HCl., acide fort pH= -log c = - log 0,05 = 1,3. S1 : H2CO3 acide faible
4 10-7(0,05-x) -x2=0 ; x2 + 4 10-7x- 2 10-8 =0 d'où x = 1,41 10-4 mol/L pH = -log(1,41 10-4 ) = 3,84. Remarque : x est très inférieur à 0,05 : on peut écrire que [H2CO3] voisin de C=0,05 mol/L alors Ka1 = [H3O+]2 /C soit pH = ½( pKa1 - log C) = 0,5(6,4-log 0,05) = 3,85.
S3 : CO3 2- : base faible
K = Ke/Ka2 = 10-14/10-10,3 = 10-3,7 = 2 10-4. x2/(0,05-x) =2 10-4. 2 10-4 (0,05-x) -x2=0 ; x2 + 2 10-4 x- 10-5 =0 d'où x = 3,06 10-3 mol/L [H3O+] =10-14/ [HO-] ; pH = 14+ log(3,06 10-3 ) = 11,5. Remarque : x est bien inférieur à 0,05 : on peut écrire que [CO3 2-] est voisin de C=0,05 mol/L. K = Ke/Ka2 =[HO-]2/C = Ke2/( C [H3O+]2; [H3O+]2 = KeKa2 /C ; pH = 7 + 0,5 (pKa2+ log C).
On veut avoir une solution tampon à pH= 10. Quels sont les différents mélanges possibles (mélanges de 2 de ces quatres solutions) ? Quelles sont les proportions (% volumique) de chaque solution ? pKa2 (HCO3 -/CO3 2-) = 10,3. Le couple acide base HCO3 -/CO3 2- va fixer le pH égal à 10. pH = pKa2 + log( [CO3 2-] /[HCO3 -] ) log( [CO3 2-] /[HCO3 -] ) = pH - pKa2 =10-10,3 = -0,3 [CO3 2-] /[HCO3 -] = 10-0,3 = 0,5 ; [HCO3 -] = 2 [CO3 2-]. Seule possibilité : ajouter de l'acide chlorhydrique à la solution S3, carbonate. couples acide base : HCO3 -/CO3 2- et H3O+/H2O. CO3 2- + H3O+ = H2O + HCO3 - ( 1) Constante d'équilibre K1 = [HCO3 -]/([H3O+][CO3 2-]) =1/Ka2 = 1010,3. K1 étant très grand, la réaction est totale. Le tableau d'avancement est réalisé à partir du mélange fictif suivant : n( carbonate) = CV0 = 0,05V0 mmol ; n (H3O+) = n0 = 0,05 V1 mmol
L'acide chlorhydrique est le réactif limittant d'où 0,05 V1 -x = 0 0,05 V1 = 0,1/3V0 ; V1 /V0 = 0,67 ( 67 %). Pourquoi n'utilise t-on pas ces couples pour des tampons vers 6,4 en pratique ? La dissolution du dioxyde de carbone atmosphérique va modifier la concentration en HCO3 - et en conséquence le pH risque de varier légèrement
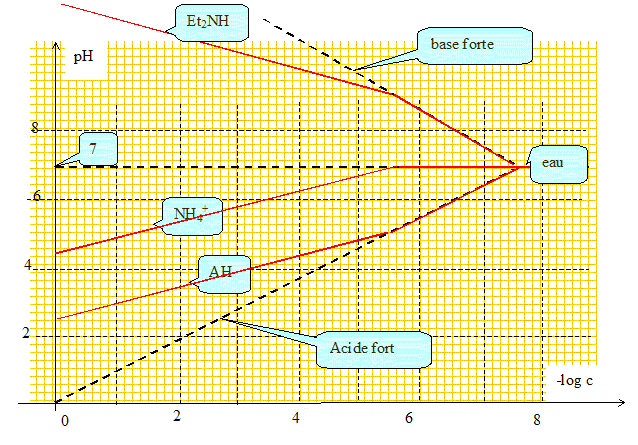
On dispose de 3 solutions (indépendantes) - d'un acide faible AH (pKa =5) - NH4+ (pKa =9) - Et2NH (pKa =10) C varie de 0,1 mol/L à 10-8 mol/L. On veut tracer pH de l'espèce dissoute dans l'eau en fonction de pC= - log C. Tracer les asymptotes de cette courbe, et justifier les calculs. acide faible : pH = ½( pKa - log C) voir détails des calculs ci-dessus. Par dilution suffisante, un acide faible se comporte comme un acide fort : pH = - log C. A dilution infinie il faut tenir
compte des ions oxonium issus de l'eau : le pH tend vers
7.
Par dilution suffisante, une base faible se comporte comme une base forte : pH =14+ log C. A dilution infinie il faut tenir compte des ions hydroxyde issus de l'eau : le pH tend vers 7.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|