|
Aluminium : atome, ion, précipitation, complexation concours Mines 07 |
|||||||
|
|||||||
|
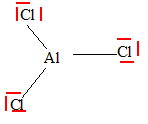
L’aluminium a pour numéro atomique Z = 13. Que signifie Z ? Quelle est la configuration électronique de l’aluminium dans l’état fondamental. Z : numéro atomique, nombre de charge, nombre d'électrons de l'atome, nombre de protons du noyau. 1s2 2s2 2p6 3s23p1 Quel est l’ion le plus probable ? Justifier. En cédant trois électrons, l'atome donne l'ion Al3+ dont la dernière couche électronique occupée est saturée. On plonge un morceau de feuille d’aluminium préalablement chauffé dans un ballon contenant du dichlore, Cl2 . Le métal s’enflamme et il se forme des fumées blanches de chlorure d’aluminium, AlCl3. Ecrire la réaction. Al + 1,5 Cl2 = AlCl3. Quelle propriété de l’aluminium met-on en évidence ? Comment évolue-t-elle dans une ligne de la classification périodique ? L'aluminium est un métal réducteur. Le caractère métallique réducteur augmente de la droite vers la gauche et de haut en bas dans la classification périodique.
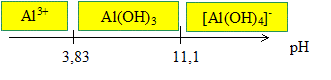
Le précipité d’hydroxyde d'aluminium, Al(OH)3(s) est un hydroxyde amphotère peu soluble qui se dissocie suivant les réactions : Al(OH)3(s) +3H3O+ = Al3+ + 6H2O en milieu acide (1) Al(OH)3(s) +HO- =[Al(OH)4]- en milieu basique (2) On donne : Al(OH)3(s) = Al3+ + 3HO- ; pKs2=32,5 Al3+ +4HO- =[Al(OH)4]- ; log b= 33,4. Calculer littéralement et numériquement les constantes d’équilibre et de ces deux réactions en fonction des données. (1) : K1 = [Al3+] / [H3O+ ]3 ; Ks2=[Al3+] [HO- ]3 soit [Al3+] =Ks2/[HO- ]3 K1 =Ks2/( [HO- ]3[H3O+ ]3) = Ks2/ / Ke3. K1 =10-32,5 / (10-14)3 =109,5 =3,16 109.
Ks2=[Al3+] [HO- ]3 soit [HO- ] = [ Ks2/[Al3+]]1/3 = [ 10-32,5 /10-2]1/3 =6,81 10-11 mol/L [H3O+ ]= Ke/ [HO- ]=10-14 / 6,81 10-11 =1,47 10-4 mol/L ; pH1 =3,83. b=[[Al(OH)4]-] /([Al3+][HO- ]4 ) soit [[Al(OH)4]-] =b[Al3+][HO- ]4 =1033,4*10-2*(6,81 10-11 )4=5,4 10-10 <<0,01.
K2 =[[Al(OH)4]-] / [HO- ] ; [HO- ] = [[Al(OH)4]-] /K2 =0,01/7,94 =1,26 10-3 mol/L [H3O+ ]= Ke/ [HO- ]=10-14 / 1,26 10-3 =7,94 10-12 mol/L ; pH1 =11,1. Ks2=[Al3+] [HO- ]3 soit [Al3+] =Ks2/[HO- ]3 =10-32,5 / (1,26 10-3)4=1,25 10-21 mol/L << 0,01. En déduire le diagramme d’existence de l’aluminium III en fonction du pH.
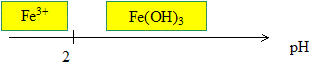
De même, l’hydroxyde de fer(III) est un sel peu soluble qui se dissocie selon Fe(OH)3(s) +3H3O+ = Fe3+ + 6H2O en milieu acide (3) On donne : Fe(OH)3(s) = Fe3+ + 3HO- ; pKs1=38,0 Calculer le pH de début de précipitation pour une concentration en élément fer C=0,01 mol/L· Ks1=[Fe3+] [HO- ]3 soit [HO- ] = [ Ks1/[Fe3+]]1/3 = [ 10-38 /10-2]1/3 =1 10-12 mol/L [H3O+ ]= Ke/ [HO- ]=10-14 / 10-12 = 10-2 mol/L ; pH =2. En déduire le diagramme d’existence du fer III en fonction du pH.
Selon le procédé de BAYER mis au point en 1887, la bauxite, une fois broyée, est mélangée à de la soude à haute température et sous pression de 20 bar. La liqueur obtenue, l'aluminate de sodium, AlO2Na, est débarrassée de ses impuretés, puis diluée et refroidie, ce qui provoque la précipitation d'oxyde d'aluminium hydraté, Al(OH)3. Pour interpréter les phénomènes, nous rappelons que Al2O3 est équivalent à Al(OH)3 ou Al2O3, 3H2O, que Fe2O3 est équivalent à Fe(OH)3 ou Fe2O3, 3H2O, et AlO2Na est équivalent à Al(OH)4 Na ou AlO2Na, 2H2O. La silice ne réagit pas avec la soude. Ecrire la réaction de la soude, NaOH sur l’alumine Al2O3 et qui donne l'aluminate de sodium, AlO2Na. Al2O3 +2 NaOH = 2 AlO2Na +H2O. Justifier à l’aide des questions précédentes que l’on puisse séparer l’aluminium par cette méthode. A pH>11,1, l'aluminium se trouve sous forme d'ion [Al(OH)4]- en solution ; les autres espèces ioniques sont précipitées sous forme d'hydroxydes solides. Justifier qualitativement que la dilution favorise la formation de l’hydroxyde. En diluant une solution basique ( pH>11,1) , la concentration en ion hydroxyde diminue : la concentration en ion oxonium augmente et le pH diminue. Dés que le pH devient inférieur à 11,1, l'hydroxyde Al(OH)3 précipite.
|
|||||||
|
|
|||||||
|
|