|
Chimie organique : synthèse de la (S)-fenfluramine concours Mines 05 |
|||||||
|
|||||||
|
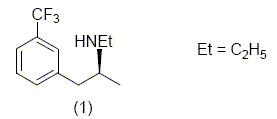
La fenfluramine est une molécule active utilisée lors de traitement contre l’obésité car elle empêche la digestion des sucres.
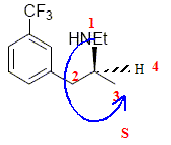
Mais seul le stéréoisomère (1) possède ces propriétés. Nous allons étudier une possibilité de synthèse de cette molécule. Etude de la molécule de fenfluramine : L’atome d’azote peut-il être un centre de chiralité ? Cette molécule est-elle chirale ? Préciser la configuration absolue du ou des centres chiraux. L'atome d'azote d'une amine peut rapidement s'inverser à 298 K : ce dernier ne peut donc pas être un centre de chiralité. Cette molécule possédant un carbone
asymétrique est chirale. La (S) fenfluramine est dextrogyre, expliquer brièvement ce que cela signifie. Existe-t-il une relation entre ce renseignement et le fait que le descripteur stéréochimique du centre d’asymétrie soit S ? La molécule fait tourner le plan de la lumière polarisée à droite. Il n'y a pas de relation entre "dextrogyre" et la nomenclature R S. Si nous envisageons une synthèse non stéréosélective, nous obtenons un mélange racémique de (S) fenfluramine et de (R) fenfluramine. Nous avons à notre disposition un
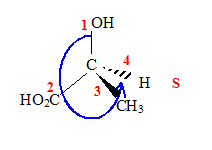
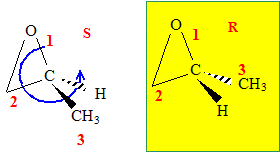
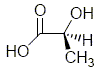
stéréoisomère de l’acide lactique
Donner la configuration absolue du carbone asymétrique de la molécule d’acide lactique.
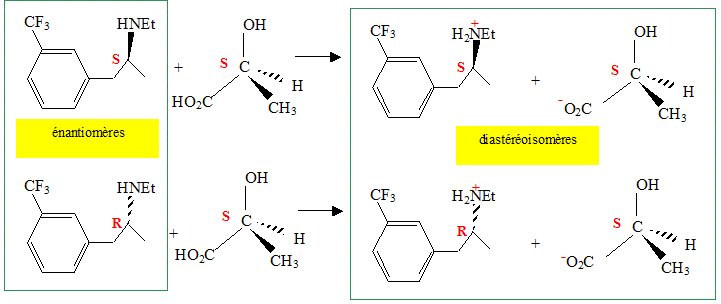
Lorsque l’on fait réagir l’acide lactique sur la fenfluramine quelle réaction observe-t-on ? En déduire une méthode expérimentale pour séparer du mélange racémique la (S) fenfluramine. Réaction acide base.
Il est impossible de séparer deux énantiomères : ils ont les mêmes propriétés chimiques et physiques ( exceptés les propriétés optiques) Il est plus facile de séparer deux diastéréoisomères : leurs propriétés chimiques et physiques présentent des différences.
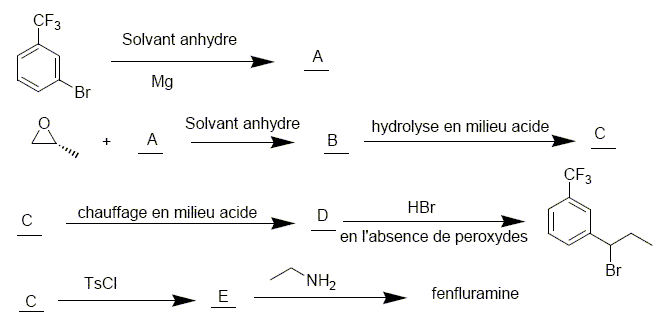
Pasteur. On réalise la séquence de réactions suivantes
TsCl est le chlorure de tosyle : p-CH3-C6H4-SO2-Cl. Justifier le type de solvant choisi pour la formation de A . Donner un exemple. Citer les précautions à prendre lors de cette synthèse. Les magnésiens sont détruits en présence d'eau. Solvant : éther éthylique anhydre. Un solvant aprotique évitera d'éventuelles réaction acide base. Précautions : utiliser un désséchant type CaCl2 anhydre à la sortie du montage. Refroidir le milieu réactionnel ( bain d'eau glacée) car la réaction est exothermique. Le solvant est de plus volatil et inflammable.
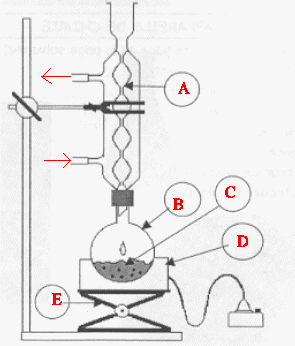
Le passage de C à D se fait par un chauffage à reflux. Faire un schéma légendé du montage expérimental utilisé. Quel est l’intérêt d’un chauffage à reflux ?
A : réfrigérant à eau ; : ballon ; D : chauffe ballon ; E : élévateur à croisillons. Le chauffage à reflux permet d'accérer la réaction en travaillant à température modérée, tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon.
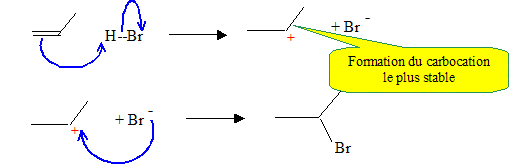
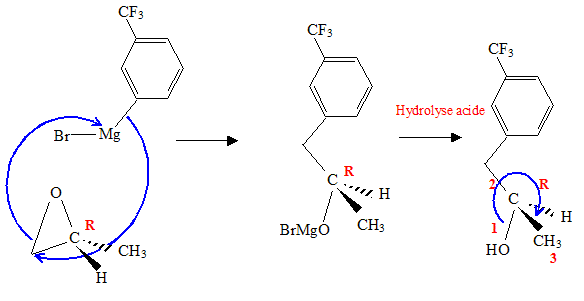
Donner le mécanisme de l’action de A sur l’époxypropane. Justifier la régiosélectivité de cette réaction, préciser la stéréochimie du produit C.
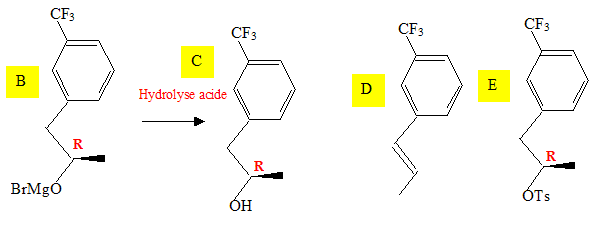
Représenter les formules topologiques de B, C, D, E.
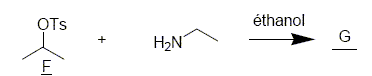
Pour étudier la dernière étape de la synthèse de la fenfluramine, on étudie la cinétique de la réaction suivante :
Quelle propriété de l’éthylamine met-on en jeu lors de cette réaction ? Déterminer G. Le doublet non liant de l'atome d'azote donne à ce dernier des propriétés nucléophiles. On constate expérimentalement que la vitesse de cette réaction possède un ordre 1 par rapport à l’éthylamine et un ordre 1 par rapport à F. Proposer un mécanisme pour cette réaction. La fenfluramine obtenue se présente-t-elle sous la forme d’un mélange racémique ? Substitution bimoléculaire SN2, stéréospécifique, inversion de configuration. La fenfluramine obtenue ne se présente pas sous la forme d’un mélange racémique.
|
|||||||
|
|
|||||||
|
|
 ainsi
que des solutions concentrées d’acide
chlorhydrique et de soude.
ainsi
que des solutions concentrées d’acide
chlorhydrique et de soude.