|
Propriété réductrice du magnésium ; dureté de l'eau : dosage par l'EDTA concours Mines 03 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le magnésium est un élément relativement abondant dans l’écorce terrestre. L’eau de mer qui contient 0,135 % de magnésium sous forme de Mg2+ peut être considérée comme une réserve quasiment inépuisable de ce métal. Propriétés atomiques. Le numéro atomique du magnésium est Z=12. Indiquer sa configuration électronique dans l’état fondamental et en déduire sa position (numéros de ligne et de colonne) dans la classification périodique. 1s2 2s2 2p6 3s2 : seconde colonne, 3ème ligne. Le tableau ci-dessous regroupe quelques propriétés atomiques du magnésium et d’éléments issus de la même colonne de la classification périodique. Il s’agit du numéro atomique (Z), du rayon atomique(ratomique), du rayon ionique du cation M2(rionique), des énergies de première et de deuxième ionisation de l’atome (Eionisation1 et Eionisation2), du potentiel redox standard du couple M2+/M (E°(M2+/M)).
Lorsque le rayon atomique augmente, les électrons de valence, plus éloignés, sont de moins en moins liés au noyau : en conséquence l'énergie de 1ère ionisation diminue. Justifier que, pour chaque atome, Eionisation2 > Eionisation1. Les rayons ioniques sont tous inférieurs aux rayons atomiques correspondants : l'électron de valence dans l'ion M+ est plus lié au noyau que dans l'atome. L'énergie de 2ème ionisation sera donc plus élevée que l'énergie de première ionisation. Des cinq éléments présentés dans ce tableau, lequel est le meilleur réducteur ? En déduire lequel est le moins électronégatif. Plus E°(M2+/M) est négatif, plus le caractère réducteur et plus le caractère métallique augmentent : Ba est le meilleur réducteur. Propriétés
réductrices du
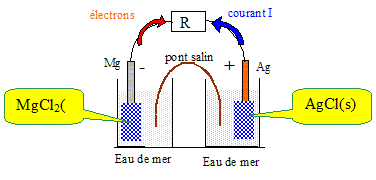
magnésium. Le magnésium sert à la fabrication
de piles amorçables à l’eau de
mer, très utilisées dans la marine.
Ce type de pile est constitué d’une
demi-pile AgCl (s) / Ag (s) et d’une demi-pile
MgCl2 (s) / Mg (s). La pile est
étanche mais peut être activée
par ouverture d’un opercule permettant le
contact entre l’eau de mer et les
électrodes. En milieu chlorure, le potentiel standard du
couple MgCl2 (s) / Mg (s) vaut
–1,71 V ; celui du couple AgCl (s) / Ag (s) vaut 0,22
V. A l'anode négative, le métal le plus réducteur s'oxyde : le métal le plus réducteur appartient au couple redox ayant le plus petit potentiel. Le magnésium s'oxyde à l'anode négative : Mg + 2Cl-= MgCl2 + 2e-. A la cathode positive, l'oxydant de l'autre couple redox se réduit : 2AgCl (s) +2e- = 2Ag(s) + 2Cl-. Quelle est la réaction de fonctionnement de la pile ? Mg (s) +2AgCl (s) = MgCl2 (s) + 2Ag(s). Faire un schéma de la pile en fonctionnement en précisant la polarité des électrodes et le sens de déplacement des électrons.
Mg + 2Cl-= MgCl2 + 2e-. E1 = E°( MgCl2 (s) / Mg (s)) +0,03 log (1/[Cl-]2) 2AgCl (s) +2e- = 2Ag(s) + 2Cl-. E2 =E° (AgCl (s) / Ag (s)) +0,03 log (1/[Cl-]2) E = E2 -E1 = E° (AgCl (s) / Ag (s)) -E°( MgCl2 (s) / Mg (s)) E = 0,22-(-1,71) = 1,93 V. Quel est le rôle de l’eau de mer ? L'eau de mer assure la continuité électrique : la migration des ions est ainsi assurée entre les électrodes.
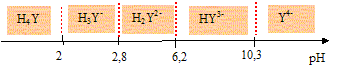
La dureté de l’eau est un concept qui a été introduit afin d’en connaître la teneur en ions Ca2+ et Mg2+. Les eaux dites dures sont des eaux riches en ions calcium et magnésium. Elles ont le défaut de faire précipiter les savons qui perdent alors leur pouvoir moussant. De plus, elles favorisent la formation de tartre (CaCO3 et MgCO3) dans les canalisations. On se propose dans cette partie de déterminer la dureté totale, c’est-à-dire la somme [Ca2+]+ [Mg2+], d’une eau minérale en la dosant à l’aide d’acide éthylènediaminetétraacétique (EDTA) noté H4Y. L’EDTA (noté H4Y) est un tétraacide dont les pKa successifs valent respectivement : 2,0 ; 2,7 ; 6,4 ; 10,2. Le mode opératoire est le suivant : « On place 10 mL d’eau à analyser dans un erlenmeyer de 150 mL. On y ajoute 10 mL d’une solution tampon de pH = 10 et 12 gouttes d’une solution de l’indicateur coloré Calmagite fraîchement préparé. La solution, incolore avant l’ajout du Calmagite, prend alors une coloration rose « lie de vin ». On place dans la burette une solution de sel disodique d’acide éthylènediaminetétraacétique dihydraté (Na2H2Y, 2 H2O) de concentration c = 0,050 mol.L–1. On appelle v le volume de titrant versé. On observe le virage de la solution du rose au bleu pour un volume versé v = ve.». Préparation des solutions. Pour préparer la solution de titrant, on introduit une masse m de sel disodique d’acide éthylènediaminetétraacétique dihydraté (Na2H2Y, 2 H2O) dans une fiole jaugée de 250 mL. On complète au trait de jauge avec de l’eau distillée. On bouche la fiole et on agite pour homogénéiser la solution. Déterminer la masse m que l’on doit peser avec précision pour obtenir une solution de concentration c = 0,050 mol.L–1. Na : 23 ; H4Y : 292 ; H : 1,0 ; O : 16,0 g/mol. Masse molaire (Na2H2Y, 2 H2O) : M = 23*2+290+36=372 g/mol. Quantité de matière dans 0,25 L : n=0,25 c = 0,25*0,05 = 0,0125 mol Masse m = n M = 0,0125*372 = 4,65 g. Indiquer les domaines de prédominance des différentes formes de l’EDTA en fonction du pH. Quelle est l’espèce prédominante à pH = 10 ?
A pH =10, la forme HY3- est majoritaire. Dans la suite du problème on considérera, par souci de simplification, que tout l’EDTA est sous cette forme à pH = 10. Pour préparer la solution de solution tampon pH = 10, on dissout une masse m’ de NH4Cl dans 100 mL de soude molaire et on complète le volume jusqu'à 250 mL avec de l'eau distillée. Ecrire l’équation-bilan de la réaction qui se produit quand on mélange ces deux réactifs. NH4+/NH3 : pKa1 = 9,2 ; H2O/HO- : pKe=14. NH4++ HO- = NH3 + H2O. Calculer sa constante d’équilibre. Que peut-on en déduire ? K = [NH3] /( [NH4+][HO-]) avec Ka1 = [NH3][H3O+] /[NH4+] soit : [NH3] /[NH4+] = Ka1 /[H3O+] Repport dans K : K = Ka1 /( [H3O+][HO-]) =Ka1 /Ke =10-9,2/10-14 =104,8 = 6,3 104. K étant grande, la réaction est totale. Faire le bilan de matière. En déduire la valeur de la masse m’ que l’on doit peser pour obtenir une solution tampon de pH = 10. Le couple NH4+/NH3 fixe le pH : pH= pKa1 + log([NH3]/[NH4+]). 10-9,2 = 0,8 = log([NH3]/[NH4+]) ; [NH3]/[NH4+] = 100,8 = 6,3 ou n(NH3) =6,3 n(NH4+) (1) Conservation de l'élément azote : n(NH3) + n(NH4+) = m'/M=m'/53,5 et en tenant compte de (1) :7,3 n(NH4+) =m'/53,5 m'=53,5*7,3 n(NH4+) =3,90 102n(NH4+) (2)
0,1-x = 2,5 10-5 soit x = 9,9975 10-2 mol n(NH4+)=(NH3)/6,3 = 9,9975 10-2 /6,3 =1,5869 10-2. (2) donne : m'= 390*1,5869 10-2 ; m' = 6,2 g.
Principe du dosage. Dans une solution tamponnée à pH 10, l'indicateur Calmagite (noté In) est rose « lie de vin » lorsqu'il est complexé au Mg2+ et il est bleu lorsqu'il n'y a aucun ion magnésium disponible. Les ions calcium ne sont pas complexés par le Calmagite. L'EDTA complexe les ions Mg2+ et Ca2+ pour donner des ions MgY2– et CaY2–. Ces complexes EDTA-métal sont incolores. Ecrire l’équation-bilan des deux réactions de titrage qui se produisent pour 0<v<ve. Mg2+ +HY3- = MgY2–+HO- ; Ca2+ +HY3- = CaY2– +HO- Ecrire l’équation-bilan de la réaction qui explique le changement de couleur se produisant à l’équivalence. Données : Mg2++In = MgIn2+ ; b = 4,9 105. Ca2+ +Y4- = CaY2– ; b' = 5,0 1010 ; Mg2+ +Y4- = MgY2– ; b" = 4,9 108. Le complexe MgIn2+ est moins stable que MgY2– : avant l'équivalence , l'EDTA étant en défaut, Mg2+ en excès, la couleur rose est due au complexe MgIn2+. Après l'équivalence , l'EDTA étant en excès, Mg2+ en défaut, le complexe MgIn2+ n'existe plus et la solution est bleue. MgIn2+ +HY3-
+HO-= MgY2– +In + H2O
gouttes de solution de Na2MgY à l’échantillon d’eau à analyser. Ecrire l’équation-bilan de la réaction prépondérante qui se produit quand on ajoute des ions MgY2– à un mélange d’ions Mg2+ et Ca2+. Formation du complexe le plus stable : MgY2– + Ca2+ = CaY2– + Mg2+.(3) Puis Mg2++In = MgIn2+ ; la coloration rose est plus intense. Calculer sa constante d’équilibre. K = [CaY2–][Mg2+] /([MgY2–][Ca2+ ]) or : Ca2+ +Y4- = CaY2– ; b' = 5,0 1010 =[CaY2–]/([Ca2+ ][Y4-]) Or Mg2+ +Y4- = MgY2– ; b" = 4,9 108=[MgY2–]/([Mg2+ ][Y4-]) Il en résulte K= b' /b" =500/4,9 = 102. Montrer que l’ajout des quelques gouttes de solution de Na2MgY ne modifie pas la valeur du volume à l’équivalence. (3) indique : la quantité de matière d'ion Ca2+ consommés est égale à la quantité de matière d'ion Mg2+ formés. La valeur du volume équivalent n'est donc pas modifiée. Résultats. Le volume d’EDTA nécessaire pour observer le virage de la solution est ve = 3,0 mL. En déduire la valeur de [Ca2+]0+ [Mg2+]0 dans l’échantillon d’eau à analyser. A l'équivalence, les quantités de matière de réactifs mis en présence sont en proportions stoéchiométriques : n0(Ca2++Mg2+) = Ve. c = 3,0 10-3 * 0,050 = 1,5 10-4 mol dans 10 mL d'eau minérale. [Ca2+]0+ [Mg2+]0 = 1,5 10-4 / 10-2 = 1,5 10-2 mol/L. Sur l’étiquette de la bouteille d’eau, le fabricant indique les teneurs en ions suivantes : Ca2+ : 467 mg.L–1 et Mg2+ : 84 mg.L–1. Ces valeurs sont-elles compatibles avec le résultat expérimental ? [Ca2+]0 = 0,467 /40 = 1,167 10-2 mol/L ; [Mg2+]0 =0,084/24,3 =3,46 10-3 mol/L. [Ca2+]0+ [Mg2+]0 =1,167 10-2 +3,46 10-3 = 1,51 10-2 mol/L. Les valeurs portées sur l'étiquette sont donc compatibles avec les résultats du dosage. Lors de l’étude de ce dosage, on n’a pas tenu compte de la formation éventuelle d’un précipité de Mg(OH)2. Justifier. Données : pKs(Mg(OH)2) = 10,7. Mg2+ + 2HO- =Mg(OH)2(s) ; [Mg2+][HO- ]2 = 10-10,7 avec [HO- ] = 10-4 mol/L le précipité apparaît dès que [Mg2+] atteint la valeur : 10-10,7 / 10-8 = 10-2,7 =2,0 10-3 mol/L Or "On place 10 mL d’eau à analyser dans un erlenmeyer de 150 mL. On y ajoute 10 mL d’une solution tampon de pH = 10." En tenant compte de la dilution : [Mg2+]max =0,5*3,46 10-3 = 1,7 10-3 mol/L. Valeur inférieure à 2
10-3 : Mg(OH)2(s) n'apparaît
pas.
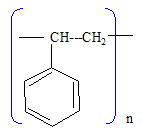
Un des traitements utilisés pour adoucir l’eau du robinet est un traitement physique par passage sur une résine échangeuse d’ions. Cette résine est préparée à partir de polystyrène. Celui-ci subit une réaction de sulfonation par action d’acide sulfurique concentré. On gorge ensuite d’eau cette résine puis on la sature en chlorure de sodium. Au contact d’eau riche en ions calcium ou magnésium, il se produit un échange de deux ions Na+ par un ion Ca2+ ou Mg2+. On rappelle la formule du styrène : Ph–CH=CH2 où Ph– désigne un radical phényle (C6H5–). Quelle est la formule du polystyrène ?
Décrire le mécanisme de l’étape d’allongement de chaîne lors de la polymérisation radicalaire du styrène. Ph–CH--CH2. + Ph–CH=CH2--> Ph–CH--CH2--CH Ph --CH2. Citer une autre utilisation courante du polystyrène. Polystyrène expansé : isolant thermique
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|