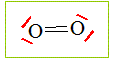|
Autour de l'oxygène, structure, dosage du dioxygène dissout, iodométrie concours Mines 03 |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Donner la structure électronique de l’atome 168O dans son état fondamental. 1s2 2s2 2p4. L’oxygène existe sous la forme de trois isotopes de nombre de masse respectifs 16, 17 et 18. Après avoir rappelé la définition du terme « isotope », préciser la composition du noyau de chacun des isotopes de l’oxygène. Deux isotopes ne diffèrent que par leur nombre de neutrons. Ils possèdent le même numéro atomique. 168O : 8 protons et 16-8 = 8 neutrons. 178O : 8 protons et 17-8 = 9 neutrons. 188O : 8 protons et 18-8 = 10 neutrons. Le plus important des corps purs simples formés avec l’oxygène est le dioxygène O2. Proposer une formule de Lewis pour la molécule de dioxygène.
L’ozone O3 est un gaz se caractérisant par son odeur forte (ozone, du grec ozein : sentir). Proposez une formule de Lewis pour cette molécule et préciser la géométrie de la molécule (on précise que la molécule d’ozone n’est pas cyclique).
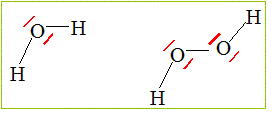
type AX2E2, en forme de V. L’eau H2O et l’eau oxygénée, ou peroxyde d’hydrogène, H2O2 sont deux molécules contenant l’élément oxygène. Proposer une formule de Lewis pour ces deux molécules.
Une expérience amusante consiste à faire dévier de sa trajectoire un mince filet d’eau à l’aide d’une règle électrisée. Comment interpréter simplement cette expérience ? La molécule d'eau est polaire.
L’eau contient en permanence du
dioxygène dissous ; ce dernier y est
consommé à la fois par les systèmes chimiques et biologiques qui
s’y trouvent. Le dosage du dioxygène
dissous dans une eau donnée permet de déterminer sa
qualité : une concentration en
dioxygène trop faible est en effet signe de pollution. La méthode de Winkler,
présentée ici, est une méthode
de dosage en retour, par iodométrie, du dioxygène dissous en solution
aqueuse. On ajoute 1,0 g de soude (ou hydroxyde de sodium) NaOH et 1,4 g de chlorure de manganèse solide MnCl2(s). On bouche alors rapidement l’erlenmeyer en veillant à ne pas y emprisonner d’air, et on agite le mélange pendant 30 minutes environ. Écrire l’équation traduisant la précipitation des ions Mn2+, provenant du chlorure de manganèse, et des ions hydroxyde HO-, provenant de la soude, en hydroxyde de manganèse (II). Le produit de solubilité correspondant vaut KS = 2.10-13. Mn2+ aq + 2HO-aq = Mn(OH)2 (s).(1) Montrer que les ions hydroxyde sont en excès par rapport aux ions manganèse (II). n(HO-) = m/MNaOH= 1,0/40 =2,5 10-2 mol n(Mn2+) = m/MMnCl2= 1,4/(55+71) =40 =1,1 10-2 mol D'après les nombres stoechiométriques de (1), 0,011 mol d'ion Mn2+ réagit avec 0,022 mol d'ion hydroxyde. Or, initialement, il y a 0,025 mol d'ion hydroxyde : ce dernier est donc en excès.
4 Mn(OH)2(s) + O2(aq) + 2 H2O = 4 Mn(OH)3(s) (2) Ceci se traduit par l’apparition d’un précipité brun dans l’erlenmeyer. Quel est le degré d’oxydation (ou nombre d’oxydation) de Mn dans Mn(OH)2(s) et Mn(OH)3(s) ? Mn(OH)2 : n.o(Mn) + 2 n.o(H) + 2 n.o(O) = 0 ; n.o(Mn) +2 +2*(-2) = 0 ; n.o(Mn) = +II. Mn(OH)3 : n.o(Mn) + 3 n.o(H) + 3 n.o(O) = 0 ; n.o(Mn) +3 +3*(-2) = 0 ; n.o(Mn) = +III. Pourquoi a-t-on pris soin de boucher rapidement, et sans emprisonner d’air, l’erlenmeyer après avoir ajouté la soude et le chlorure de manganèse (II) ? Il faut éviter que le dioxygène de l'air se dissolvent dans la solution. Le but de la manipulation étant le dosage du dioxygène dissous, quel composé, de Mn(OH)2(s) et de O2(aq), doit être en excès ? Mn(OH)2(s) doit être en excès : tout le dioxygène dissout doit réagir avec Mn(OH)2(s).
Ceci a pour effet de rendre la solution acide et de dissoudre les hydroxydes du manganèse selon les réactions quantitatives et rapides suivantes : Mn(OH)3(s) formé + 3 H+ = Mn3+ + 3 H2O (3) Mn(OH)2(s) + 2 H+ = Mn2+ + 2 H2O (4) On admet qu’au pH où se trouve à présent la solution, le dioxygène dissous ne peut plus oxyder le manganèse (II). Pourquoi l’ajout d’acide sulfurique doit-il être rapide ? Est-il nécessaire de reboucher l’erlenmeyer après cet ajout ? Avant l'ajout d'acide, il ne faut pas que le dioxygène de l'air se dissolvent dans la solution. Après l'ajout, on peut laisser l'erlenmeyer ouvert, car il n'y a plus d'oxydation possible par O2 dissout en milieu acide. 4ème étape : On ajoute alors 3 g de iodure de potassium KI(s). Écrire l’équation, notée (5), traduisant la réaction d’oxydoréduction se produisant entre les ions iodure I- et les ions manganèse (III) Mn3+. 2I- = I2 + 2e-, oxydation 2Mn3+ + 2e- = 2Mn2+, réduction. 2Mn3+ + 2I- = I2 +2Mn2+ (5) ; K = [Mn2+]2[I2] / ([I-]2[Mn3+]2) Calculer sa constante d’équilibre. Cette réaction est elle quantitative ? E1 = E°[I2/I-) + 0,03 log ([I2] / [I-]2) E2 = E°[Mn3+/Mn2+) + 0,06 log ([Mn3+] / [Mn2+])= E°[Mn3+/Mn2+) + 0,03 log ([Mn3+]2 / [Mn2+]2) A l'équilibre E1 =E2 : E°[Mn3+/Mn2+)-E°[I2/I-) = 0,03 log [Mn2+]2[I2] / ([I-]2[Mn3+]2)= 0,03 log K log K =(1,51-0,62)/0,03 = 29,7 ; K= 4,6 1029. K est très grande, la réaction est donc quantitative.
5ème étape : On pipette alors exactement V0 = 50,0 mL de cette solution que l’on dose par une solution de thiosulfate de sodium de concentration C = 1,0.10-2 mol.L-1, en présence d’empois d’amidon. Soit Ve le volume à l’équivalence. Écrire l’équation, notée (6), traduisant cette réaction de dosage. I2 + 2S2O32- = 2I-+S4O62-.(6) À quoi sert l’empois d’amidon ajouté ? Indicateur de fin de réaction : en présence de diiode, l'empois d'amidon donne une couleur violette foncée. En utilisant les équations redox écrites, déterminer la relation entre la concentration initiale en oxygène dissous dans cette eau, [O2(aq)], le volume équivalent Ve, le volume pipetté V0 et la concentration en thiosulfate de sodium C. d'après (6) : n(I2) = ½n(S2O32- ); V0[I2]==½CVe dans un volume V0 = 50 mL Soit pour un volume de 250 mL : n(I2) = 2,5CVe. d'après (5) : n(Mn3+) =2n(I2) d'après (3) : n(Mn3+) =n(Mn(OH)3) d'après (2) : n(O2) =0,25 n(Mn(OH)3) = 0,25 *2n(I2) = 1,25 CVe dans un volume de 250 mL (5 V0). [O2]= n(O2) / (5 V0) = 1,25 CVe / (5 V0) ; [O2] =0,25 CVe /V0. On obtient un volume équivalent Ve = 11,0 mL. Déterminer la concentration en dioxygène dissout dans cette eau. [O2] =0,25 CVe /V0 = 0,25*0,01 *11/50 =5,5 10-4 mol/L. soit 32*5,5 10-4 = 1,8 10-2 g/L = 18 mg/L. Qualifier l’eau dosée d’après le tableau présenté ci-après.
En considérant les équations redox écrites, trouver la relation bilan entre O2 et I-. 4 Mn(OH)2(s) + O2(aq) + 2 H2O = 4 Mn(OH)3(s) (2) 4 Mn(OH)3(s) formé +12 H+ = 4Mn3+ + 12 H2O (3) 4Mn3+ +4I- = 2I2 +4Mn2+ (5) Faire la somme, d'où : 4 Mn(OH)2(s) + O2(aq) +12 H+ +4I- =2I2 +4Mn2++ 10 H2O. Quel est donc le rôle des ions Mn3+ ? L'ion manganèse III n'apparaît pas dans ce bilan : il joue le rôle de catalyseur. |
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|