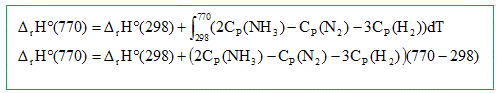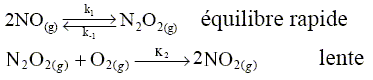|
Critère d'évolution spontané ; loi de Hess ; enthalpie ; cinétique Mines - Agrégation. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Nom de l'ester obtenu, en nomenclature systématique : CH3-COO-CH2-CH2-CH2-CH2-CH3 étanoate de pentyle. Expression et valeur de la constante K de l'équilibre : A + P = E + H2O ; K= aE, éq aH2O, éq / (aA, éq aP, éq) = nE, éq nH2O, éq / (nA, éq nP, éq) avec nE, éq = nH2O, éq =1,32 mol et nA, éq = nP, éq = 2-1,32 = 0,68 mol K= (1,32/0,68)2 = 3,77. Enthalpie standard DrH°de la réaction à 298 K : enthalpie standard DdisH° de dissociation de liaison à 298 K :
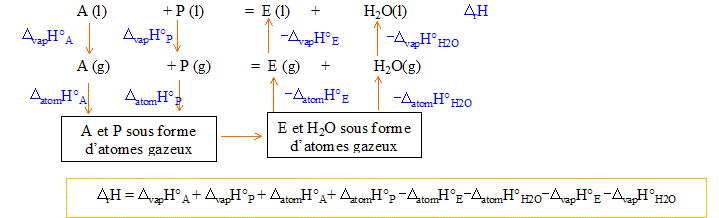
DatomH°P=11DdisH°(C-H)
+4DdisH°(C-C)
+DdisH°(O-H)
+DdisH°(C-O)
L'équilibre étant réalisé, on ajoute à température et pression constante, 2,00 moles d'acide éthanoïque. Evolution de l'équilibre : quotient initial Qi ( juste avant l'ajout d'acide) : Qi = nE, i nH2O,i / (nA, i nP, i) Qi = 1,32*1,32/ (2,68*0,68) = 0,96 Le quotient initial étant inférieur à la constante d'équilibre, l'équilibre se déplace dans le sens direct. Composition de l'équilibre :
3,77 (2,68-xéq)(0,68-xéq) = (1,32+xéq)2 la résolution donne xéq =
0,36
mol.
N2 +
3H2 = 2NH3. Dr H° =2Df H° ( NH3 ) - 3Df H° ( H2 )-Df H° ( N2 ) Dr H° =2*(-46,210 )= -92,42 kJ/mol. Calculer l'enthalpie de réaction, Dr H° ( kJ/mol ) à 770 K. La réaction est-elle exothermique ou endothermique ?
Dr H° ( 770) = -92,42 103 + (2*28,05 - 29,63-3*28,91)* 472= -120,9 kJ/mol. L'enthalpie de réaction étant négative, la réaction est exothermique. L'ammoniac peut ensuite en présence du dioxygène O2 s'oxyder en monoxyde d'azote NO et vapeur d'eau H2O. Ecrire la reaction. 4 NH3 (g) +5 O2 (g) =4 NO(g) + 6 H2O (g). Le monoxyde s'oxyde ensuite selon : 2 NO(g) +O2 (g) = 2NO2(g). En se fondant sur la notion de molécularité, justifier le fait que cette réaction n'ait pas lieu en une seule étape selon 2 NO(g) +O2 (g) = 2NO2(g). Il est très peu probable qu'un choc efficace se produise entre trois molécules. Le mécanisme proposé est le suivant :
La vitesse de la réaction est définie par la relation : v =½ d[NO2]/dt où [NO2] est la concentration de NO2. Le mécanisme est-il par stade ou en chaîne ? Justifier. L'intermédiaire N2O2 est consommée à l'étape 2 ; il n'est plus régénéré : donc mécanisme par stades. Calculer la vitesse en fonction de k1, k-1 ,k2 ,[NO] et [O2]. Quel est l'ordre global de la réaction ? L'étape 2 donne : d[NO2]/dt =2k2 [N2O2][O2] d[N2O2]/dt = k1[NO]2-k-1[N2O2]-k2[N2O2][O2] [N2O2]
est un intermédiaire très réactif , il
réagit au fur et à mesure qu'il se forme : par
conséquent d[N2O2]/dt
=0. ~
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|