|
Dosage du mélange carbonate et bicarbonate par l'acide chlorhydrique |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
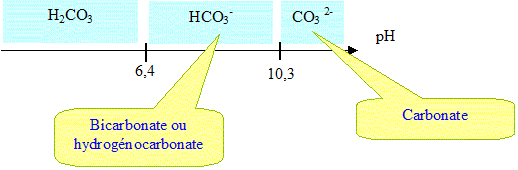
pKa1 (H2CO3/HCO3 - )= 6,4 ; pKa2 (HCO3 -/CO3 2-) = 10,3. D'après le diagramme de prédominance, le dosage présente-t-il un ou deux sauts de pH ? Les pKa étant suffisamment distincts, le dosage présente deux sauts de pH. Associer à chaque saut un bilan et un volume équivalent précisé numériquement. HCO3 -/CO3
2- et
H3O+/H2O. CO3 2- +
H3O+ = H2O +
HCO3 - (
1) K1 étant très grand, la réaction est totale. Le tableau d'avancement est réalisé à partir du mélange fictif suivant : n( carbonate) = C1V0 = 0,01*100 = 1 mmol ; n(bicarbonate) = C2V0 = 0,005*100 = 0,5 mmol ; n (H3O+) = n0, en excès. On note V (mL) le volume d'acide versé.
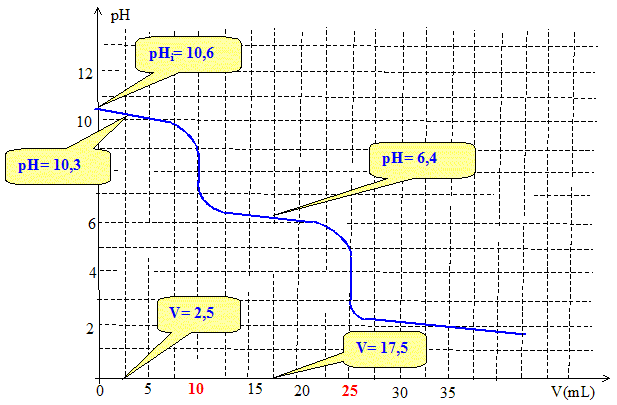
Véq 2-Véq 1 = 15 mL ; Véq 2 = 25 mL. Déterminer le pH initial de la solution titrée. Avant la 1ère équivalence, les ions carbonate CO3 2- et bicarbonate HCO3 - sont en excès par rapport à H2CO3. Le couple acide base HCO3 - / CO3 2- fixe le pH : pH = pKa1 + log ([CO3 2- ]/[HCO3 -]) pH initial : pHinitial = 10,3 + log (1/0,5)10,3 +0,3 ; pHinitial = 10,6. Calcul du pH pour quelques valeurs de V. V = 5 mL ( 1ère demi équivalence) pH = pKa1 + log ([CO3 2- ]/[HCO3 -]) avec [CO3 2- ]/[HCO3 -] = 0,5/1 = 0,5 pH = 10,3 + log 0,5 = 10. Entre la 1ère et la seconde équivalence, les ions carbonates HCO3 - et H2CO3 ( CO2 dissout) sont en excès par rapport à CO32-. Le couple acide base H2CO3 / HCO3 - fixe le pH : pH = pKa2 + log ([HCO3 -]/H2CO3 ) V= 15 mL : pH = 6,4 + log (1/0,5) = 6,7 V= 20 mL : pH = 6,4 + log (0,5/1) = 6,1 Après la seconde équivalence, l'acide chlorhydrique en excès fixe le pH. V = 30 mL : excès de 5 mL d'acide chlorhydrique [H3O+] = C*5/(100+30) = 0,5/130 = 3,8 10-3 mol/L pH = - log 3,8 10-3 = 2,4.
Lors du dosage, le mélange titré constitue t il parfois un mélange tampon ? Pour quelles valeurs de V ? Mélange tampon si [ acide] = [ base conjuguée] ; le pH est alors égal au pKa du couple acide base. Avant la 1ère équivalence pH= pKa2 si : 1-0,1 V = 0,5 + 0,1 V 0,5 = 0,2 V soit V = 2,5 mL. Avant la 1ème équivalence pH= pKa1 si : 1,5-0,1 (V-Véq 1) = 0,1 (V-Véq 1) 1,5 = 0,2 (V-Véq 1) ; V-Véq 1=7,5 soit V = 17,5 mL.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|