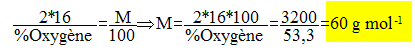|
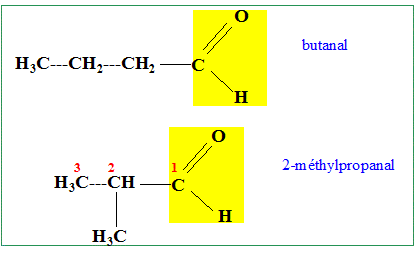
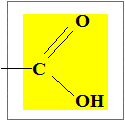
Composés oxygénés : aldehyde et acide carboxylique. |
||||||||
|
||||||||
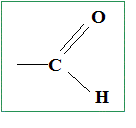
La formule brute d'un aldehyde saturé comportant n carbone est : Cn H2nO avec n entier n =1 ou 2 ou 3... La densité par rapport à l'air, notée d, d'un aldehyde gazeux est d'environ 2,5. Sachant que la masse molaire M=29 d, la masse molaire de cet aldehyde est : M= 29*2,5 = 72,5 ; on arrondi à M= 72 g/mol. La valeur de n, le nombre d'atomes de carbone de la molécule est donc : masse atomique molaire : C : 12 g/mol ; H = 1,0 g/mol ; O : 16 g/mol. M= 12 n + 2n +16= 14 n +16 Or M=72 d'où : 14n +16 = 72 soit : n =(72-16) / 14 ; n=4. Les formules semi-développées et les noms correspondants de tous les aldehydes isomères sont :
Un acide carboxylique saturé contient 53,3% d'oxygène en masse. La masse molaire de l'acide est :
La valeur n, le nombre d'atomes de carbone de la molécule est : M = 12 n+2n+2*16 = 60 ; 14 n = 60-32 ; 14 n=28 ; n=2. La formule brute est : C2 H4O2 La formule semi-developpée et le nom sont :
On donne en g/mol les masses molaires atomiques : C:16 ; H:1 ;O: 16. Déterminer les formules semi- développees et les noms des composés A, B et D. Masse molaire de l'alcène : M=29 d ; M=29*0,97 = 28 g/mol Formule brute d'un alcène : CnH2n d'où M = 12 n+2n = 28 soit n=2 A est identifié à l'éthylène H2C=CH2. " B réagit positivement sur la DNPH et le réactif de Schiff. " B est un aldehyde, l'éthanal H3C-CHO. L'oxydation d'un aldehyde donne un acide carboxylique, ici, l'acide éthanoïque H3C-COOH. Ecrire les équations bilans des réactions de A sur le dioxygène ( réaction 1 ), de B sur le dioxygène (applée réaction 2 ). H2C=CH2 + ½O2 = H3C-CHO (1). H3C-CHO + ½O2 = H3C-COOH (2). A partir de 18 litres de gaz A on obtient 35 g d'un mélange de B et D. Dans les conditions de l'expérience le volume molaire gazeux est 24 L/mol. En supposant la réaction 1 totale, quelle est la composition molaire du mélange de B et D ? Quantité de matière de A : nA = volume (L) / volume molaire (L/mol) nA = 18/24 = 0,75 mol. On note nB et nD les quantités de matière respectives de B et D. nA = nB + nD = 0,75 (3). De plus une masse est une quantité de matière (mol) fois une masse molaire (g/mol) MB=2*12+4+16 = 44 g/mol ; MD=2*12+4+16*2 = 60 g/mol La masse du mélange est égale à la somme des masses des constituants : 44nB + 60nD = 35 (4). (3) donne nB = 0,75-nD ; repport dans (4) : 44( 0,75-nD )+60nD =35. 33+16nD =35 ; nD =0,125 mol et nB =0,625 mol. En réalité le rendement de la réaction 1 est de 80 %. Trouver la composition du mélange. Dans les calculs précédents remplacer 0,75 par 0,75*0,8 = 0,6. 44( 0,6-nD )+60nD =35 ; 26,4 +16nD =35 ; nD =0,54 mol et nB =0,06 mol. Indiquer deux autres façons de préparer le composé B. ( on écrira les équations des réactions proposées). Oxydation ménagée de l'alcool éthylique : C2H5OH +½O2 = CH3-CHO + H2O. Addition d'eau sur l'acéthylène en présence de sulfate de mercure : C2H2+H2O= CH3-CHO.
|
||||||||
|
|
||||||||
|
|