|
Concours technicien police technique et scientifique externe 2008. Synthèse de l'ammoniac, acide base, atomistique |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Données à 298 K ; R= 8,31 J K-1 mol-1. Les gaz sonr assimilés à des gaz parfaits. On donne les enthalpies standard de
formation et les entropies standard de certains
composés chimiques. Calculer l'enthalpie standart DrH° de la réaction de synthèse de l'ammoniac à 298 K. N2(g) + 3 H2(g) = 2NH3(g) DrH° =2DfH° (NH3(g)) - 3DfH° (H2(g))-DfH° (N2(g)) = 2*(-46,19) = -92,38 kJ. La réaction est-elle exothermique, endothermique, athermique ? Justifier . DrH° < 0, la réaction est exothermique. Calculer l'entropis standard de cette réaction à 298 K. S° =2S° (NH3(g)) - 3S° (H2(g))-S° (N2(g)) = 2*192,5-3*130,6-191,5 = -198,3 J K-1.
Cette réaction
est-elle thermodynamiquement possible à 298
K dans les conditions standard ?
Justifier. DrG°
= DrH°-T
S° DrG°
= -92,38-298(-0,198,3) =
-33,28
kJ. DrG°
<0, cette réaction est
thermodynamiquement
possible.
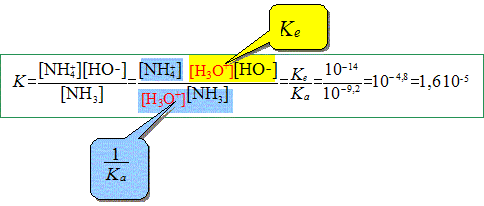
En solution aqueuse l'ammoniac réagit avec l'eau. Il s'établit l'équilibre acido-basique suivant : NH3 (aq) + H2O(l) = NH4+(aq) + HO-(aq). Que vaut le pH de la solution si la concentration en NH3 initialement mis en solution est c0=1,0 10-5 mol/L ?
On établit le tableau d'avancement avec 1 L de solution.
K =x2fin / (1,0 10-5 -xfin) = 1,6 10-5 ; x2fin + 1,6 10-5xfin - 1,6 10-10=0 D½ = 3,0 10-5 ; xfin =7,0 10-6 ; [HO-]fin =7,0 10-6 mol/L [H3O+]fin =10-14/ 7,0 10-6=1,4 10-9 mol/L ; pH= 8,8.
Exercice 2. A quoi correspond le numéro atomique d'un élément ? Nombre d'électrons, nombre de protons, nombre de charge. Donner la définition de la masse atomique d'un atome. Masse d'une moles d'atomes. Donner le nombre de neutrons, protons et électrons dans les atomes ou ions suivants : S, N, C, O, Fe3+, F-.
Même numéro atomique, mais des nombres de neutrons différents. Donner la structure électronique des éléments chimiques suivants et préciser leur nombre de protons et électrons :
Chaque atome a tendance à compléter à 8 sa couche électronique externe ( règle de l'octet).
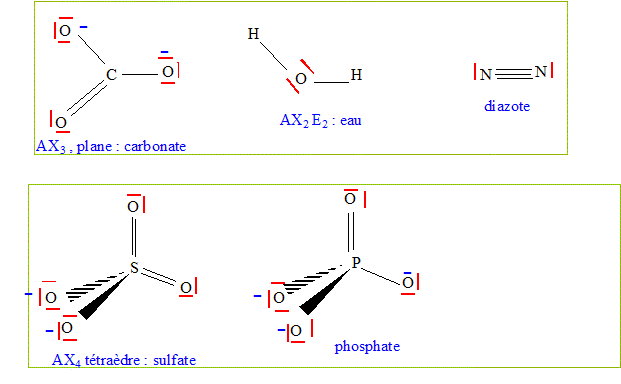
Donner la structure de Lewis des ions suivants et les nommer : CO32- ; SO42- ; PO43- ; H2O ; N2.
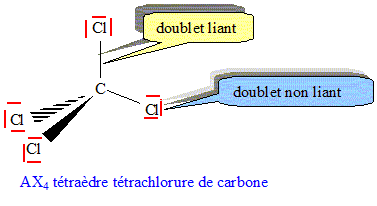
Parmi les molécules suivantes, une seule vérifie la règle de l'octet. Laquelle ? Donner sa formule de Lewis en indiquant ce que signifie chaque tiret. CCl, CCl2, CCl3, CCl4, CCl5, CCl6, CCl7.
Nommer les différents types de liaisons intermoléculaires, moléculaires et atomiques. Placer les par ordre croissant d'énergie. Liaison de van der Waals faible : interaction entre moments dipolaires électriques. Liaison intermoléculaire faible : liaison hydrogène Liaison ionique forte entre ions : interactions électrostatiques. Liaison métallique entre atome Liaison chimique forte entre atome d'une molécule, intramoléculaire : liaison covalente.
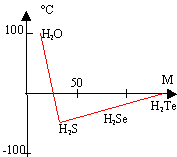
Les
températures d'ébullition augmentent
avec la masse molaire sauf pour l'eau où la
valeur est anormalement élevée.
Explication : présence de liaisons
hydrogènes intermoléculaires formant
des associations moléculaires. D'autre
part H2Te est plus polarisable que
H2Se ; les interactions de London seront
plus grandes dans H2Te que dans
H2Se : la température
d'ébullition de H2Te sera plus
grande que celle de
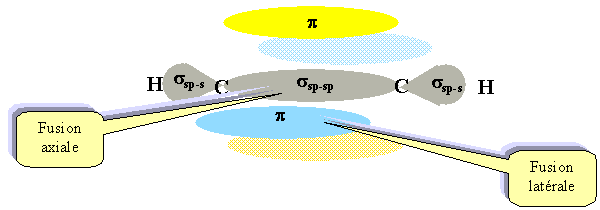
H2Se. Hydrogène : 1s ; carbone : 1s2 2s2 2p2.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|