|
Concours technicien police technique et scientifique 2008. Les 30 dernières questions. |
|||||||
|
|||||||
|
Que vaut la constante Kp 350 K ? ( 5,77 ; 0,0467 ; 0,589 ; 2,15) ln(KP 350 K /KP 300 K ) = DH°/R [1/300 - 1/350] = 61,9/8,31*(3,333-2,857) =3,545 KP 350 K /KP 300 K =34,66 ; KP 350 K =0,166*34,66 =5,75. Quel est le pH d'une solution d'acide nitrique de concentration c=3,7 10-9 mol/L ? (6 ; 7 ; 8 ; 8,4) Dans cette solution les ions oxonium issus de l'eau l'emportent sur ceux issus de l'acide nitrique. Le pH est donc voisin de celui de l'eau pure : 7. Quelle est la constante d'acidité Ka de l'acide méthanoïque à 25°C ? (9,9 10-3 ; 8,61 ; 1,8 10-4 ; 7,9 10-9) Données : DG° = 21,3 kJ/mol. ln K = -DG°/(RT) = -21 300/(8,31*298) = -8,60 ; K = 1,8 10-4. Dans la très grande majorité des cas, lorsqu'une molécule ne présente aucun élément de symétrie, elle est: optique ; magnétique dipolaire ; thermique. Un mélange équimolaire des deux énantiomères est un mélange : équilibrée ; racémique ; rationique ; aracémique. Si l'on raccorde, dans l'installation de chauffage central à eau chaude, une canalisation en cuivre et un radiateur en acier, que risque t-il de se produire ? une explosion ; une précipitation ; une corrosion électrochimique ; un incendie.
Elles présentent une double liaison
>C=N-OH. Le chlorure de sodium a
une structure cristalline de type : orthorombique centrée ; cubique
centrée ; rhomboèdrique ;
cubique à faces
centrées.
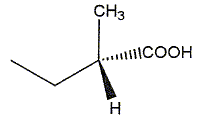
La molécule suivante se nomme :
acide (2R)-1-méthylbutanoïque ; acide (2S)-1-méthylbutanoïque ; acide (2S)-2-méthylbutanoïque ; acide (2R)-2-méthylbutanoïque
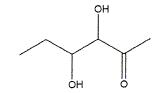
Parmi les propriétés suivantes concernant les alcools, laquelle est fausse : Les alcools primaires sont plus acides que les alcools tertiaires. Les alcools secondaires sont facilement oxydés en cétone. Le pentan-2-ol est un alcool tertiaire. Le carbone porteur du groupe OH d'un alcool est hybridé sp3. Parmi les propriétés suivantes concernant les acides carboxyliques, laquelle est exacte : L'acide acétique est de formule HCOOH et l'acide formique CH3-COOH. Les solutions aqueuses de sels de sodium d'acides carboxyliques ont un pH acide. Les sels de sodium des acides carboxyliques sont solubles dans l'eau. L'acide chloroacétique a un pKa supérieur à l'acide acétique. La transformation de l'état solide à l'état gazeux se nomme : évaporation ; vaporisation ; condensation ; sublimation. Au cours d'une transformation spontanée ( donc irréversible) s'effectuant à pression constante, l'enthalpie libre ( fonction de Gibbs) s'écrit ( S et h étant l'entropie du système et t la température) : G = S-TH ; G = S+TH ; G = H-TS ; G= H+TS. Au cours d'une transformation spontanée s'effectuant à pression et température constantes, l'enthalpie libre ne peut que diminuer ; lorsque sa valeur atteint un minimum, le système parvient à un état : réversible ; irréversible ; d'équilibre ; non stationnaire.
Toute augmentation du nombre d'oxydation est une : oxydation ; réduction ; dismutation ; oxydo-réduction catalysée par H2SO4. La solubilité du chlorate d'argent AgClO3 est 0,52 mol/L à 15°C. Son produit de solubilité Ks vaut : 0,27 ; 0,54 ; 0,72 ; 5,4 10-2. AgClO3(s) = Ag+aq + ClO3-aq ; Ks = [Ag+aq][ClO3-aq]=0,52*0,52 = 0,27. Dans le cas d'une détente isotherme irréversible, le travail W de la transformation du gaz supposé parfait d'un volume V1 à un volume V2 est : [ W=-Pext(V2-V1) ; W=0 ; W = -nRT ln(V2/V1) ; W = -nRT ln(V2/V1)] dWirr =- P ext dV ; Wirr = -Pext(V2-V1). Dans le cas d'une transformation isotherme irréversible d'un gaz supposé parfait ( d'un volume V1 à un volume V2 ), la variation d'entropie de l'extérieur est : [DSext = -Pext(V2-V1)/T ; DSext =-nR ln (V2/V1) ; DSext = R ln (V2/V1) ; DSext =0 ] L'entropie est une fonction d'état, sa variation ne dépend que de l'état initial et de l'état final, peu importe le chemin suivi. On imagine une transformation réversible conduisant de V1 à V2 : dans une transformation isotherme, l'énergie interne du gaz ne varie pas. dU= d W+dQ= 0 ; d W = -PdV ; dQ= PdV dS = dQ/T = PdV /T = nR dV/V = nR d(lnV) d'où DS = nR ln (V2/V1) . Une réaction d'oxydoréduction représentée par le bilan : a Ox1 +b Red2 = c Red1 + d Ox2 s'accompagne d'une variation d'enthalpie libre ( avec a : activité chimique) :
Une transformation s'effectuant à pression constante est appelée : isobare ; isotherme ; isochore ; isotope.
L'acide formique doit son nom à : la forme de sa chaîne ; a son acicité ; à sa présence chez la fourmi ; aucune réponse ne convient.
III ; V ; VI ; VII. 2 n.o(Cr) + 7n.o(O) = -2 ; 2
n.o(Cr) +7*(-2)=-2 d'où n.o(Cr)= 6.
CuO ; Cu2O ; CuO2 ; Cu2O2. |
|||||||
|
|
|||||||
|
|
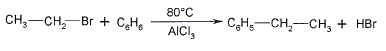
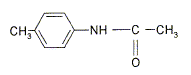
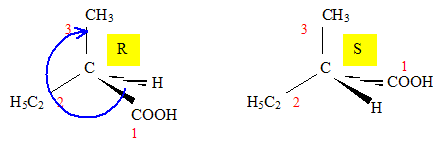
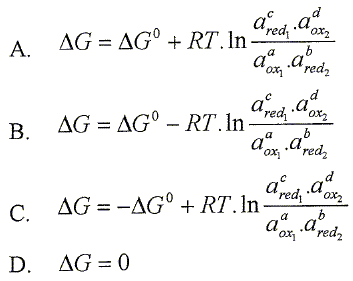 A.
A.