|
suivi manométrique, propanoate de 2-méthylpropyle. Concours manipulateur électroradiologie médicale Poitiers 2008 |
|||||||
|
|||||||
|
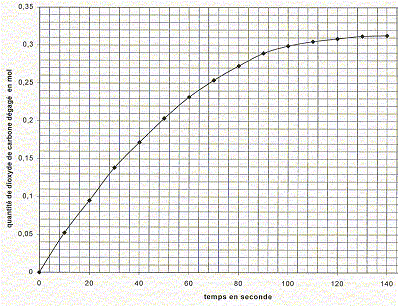
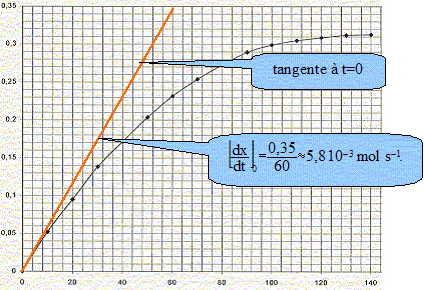
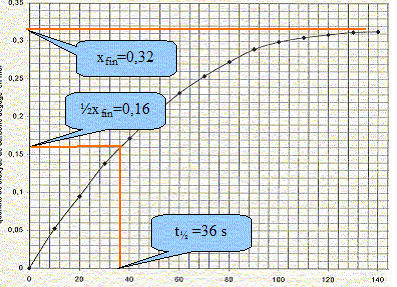
Dans un flacon de volume V= 1000 mL, on introduit un volume V1 = 100 mL d'acide chlorhydrique. Le flacon est bouché et un manomètre mesure la pression du gaz contenu dans le flacon. La température est maintenue constante q= 20°C. A la date t=0, on introduit le carbonate de calcium. A intervalles de temps réguliers, on relève la pression indiquée par le manomètre. La réaction chimique peut être modélisée par l'équation suivante : CaCO3(s) + 2 H3O+aq = Ca2+aq + CO2(g) + 3H2O(l). Est ce une réaction d'oxydo-réduction ou une réaction acidobasique. Justifier. On identifie plusieurs couples acide / base : réaction acidobasique couples acides bases : CO32- aq / HCO3- aq ; H2O, CO2aq / HCO3- aq et H3O+aq /H2O(l) Ecrire les demi-équations associées aux couples mis en jeu. CO32- aq + H+aq = HCO3- aq ; HCO3- aq + H+aq = H2O, CO2 aq ; 2H3O+aq = 2H2O(l) + 2H+aq. Pourquoi maintenir la température du milieu réactionnel constante ? La température est un facteur cinétique ; si celle-ci varie, la vitesse de réaction change. A l'instant t=0, juste avant que la réaction se produise, la pression du gaz dans le flacon est P0. A l'instant t, la pression est P. La pression du gaz dans le flacon vérifie la loi des gaz parfaits. Déterminer le volume V2, considéré constant, occupé par les gaz dans le flacon à l'instant t si on néglige le volume de gaz dans le tuyau du manomètre. V2 = V-V1 ( en mL) Exprimer en fonction de P0, P, V2, R et q, la quantité de matière n0 des gaz présents à l'instant t=0, puis la quantité de matière nt des gaz présents à l'instant t. En déduire l'expression littérale de la quantité de matière n(CO2) de dioxyde de carbone dégagé à l'instant t. nair = n0 = P0 V2/(R (q+273)) nair + nCO2 = nt= P V2/(R (q+273)) nCO2 = nt-n0 =(P-P0 )V2/(R (q+273)) . R= 8,31 S.I ; P0 = 1010 hPa ; P= 1825
hPa. P-P0 =
(1825-1010)*100 = 8,15
104 Pa ; V2
= 1-0,1 = 0,9 L
= 9 10-4
m3. n100 = 8,15
104 * 9 10-4
/(8,31*293) =0,030
mol.
Synthèse d'un arôme. On veut préparer un arôme dont l'odeur rappelle celle du rhum : le propanaote de 2-méthylpropyle. On réalise cette synthèse par action de l'acide propanoïque noté A, sur un alcool noté B. Titrage de l'acide propanoïque. On connaît la concentration approximative de l'acide cA= 4,5 mol/L. On veut vérifier cette concentration en effectuant un dosage. Pour cela on dilue 20 fois la solution acide, on prélève 20,0 mL de cette solution que l'on verse dans un erlenmeyer en ajoutant quelques gouttes de phénolphtaléine et on y dose l'acide présent par une solution aqueuse de soude ( hydroxyde de sodium Na+aq + HO-aq) de concentration cB= 0,250 mol/L. Il faut verser un volume VE = 17,6 mL pour obtenir l'équivalence acidobasique. Ecrire l'équation de la réaction de dosage. CH3-CH2-COOH + HO- = CH3-CH2-COO- + H2O Définir l'équivalence acidobasique. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence l'un des réactifs est en excès, après l'équivalence, l'autre réactif est en excès Calculer la concentration c'A de l'acide dilué puis cA de l'acide A. A l'équivalence C'A *20 = CB VE ; C'A = CB VE /20 = 0,250*17,6/20 = 0,22 mol/L CA = 20 C'A = 20*0,22 = 4,4 mol/L. En calculant l'écart relatif entre la valeur trouvée et celle prévue, montrer que cA peut être utilisé pour la suite de l'expérience. (4,5-4,4) / 4,45*100 = 2,3 % Cet écart étant faible cA = 4,5 mol/L.
Estérification. Alcool B : (CH3)2CH-CH2OH ; d = 0,808 ; M= 74,0 g/mol. Ester : CH3-CH2-COO- CH2-CH(CH3)2 ME= 130 g/mol. On utilise un montage à reflux. On introduit dans un ballon 50,0 mL d'acide propanoïque A, 20,0 mL d'alcool B et 1 mL d'acide sulfurique concentré. On ajoute quelques grains de pièrre ponce et on chauffe pendant environ une heure. Ecrire l'équation de la réaction d'estérification. Préciser le nom et la classe de l'alcool B. CH3-CH2-COOH + (CH3)2CH-CH2OH = CH3-CH2-COO- CH2-CH(CH3)2 +H2O. alcool primaire : 2-méthylpropan-1-ol. Quel est le rôle du montage à reflux ? Le montage à reflux permet d'accélérer la réaction en travaillant à température modérée, tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Montrer que le mélange peut être considéré comme équimolaire. acide : na = CA*50/1000 = 4,5*50/1000 = 0,225 mol~ 0,22 mol. alcool : masse mB = 20,0*0,808 = 16,16 g nB= mB/MB =16,16/74 = 0,218 mol ~ 0,22 mol. Calculer le rendement et le comparer avec le rendement théorique. On récupère 16,9 g d'ester Dans le cas d'une réaction totale on peut obtenir 0,218 mol d'ester soit 0,218*130 = 28,3 g rendement 16,9/28,3*100 ~ 60 %. Le rendement théorique, à partir du mélange équimolaire d'un alcool primaire et d'un acide carboxylique est 66,7 %. A 10 % près la valeur obtenue est proche du rendement théorique. Pour obtenir une transformation rapide et totale on peut remplacer l'acide par l'un de ces dérivés : lequel ? Donner son nom et sa formule. anhydride propanoïque : [ CH3-CH2-CO]2 O. ou bien le chlorure de propanoyle : CH3-CH2-COCl.
|
|||||||
|
|
|||||||
|
|