|
Suivi cinétique par conductimétrie : autour du 2-méthylpropan-2-ol concours kiné Nantes 2008 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
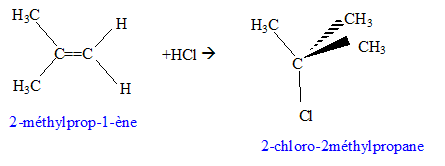
CH3-CH2-CH=CH2 : but-1-ène. Lequel de ces alcènes permet d'obtenir le 2-chloor-2-méthylpropane par action du chlorure d'hydrogène. Donner la formule de ce dérivé chloré et écrire la realation correspondante. RCl + 2H2O --> R-OH + Cl-
+ H3O+. On suit la cinétique de cette hydrolyse
par conductimétrie.
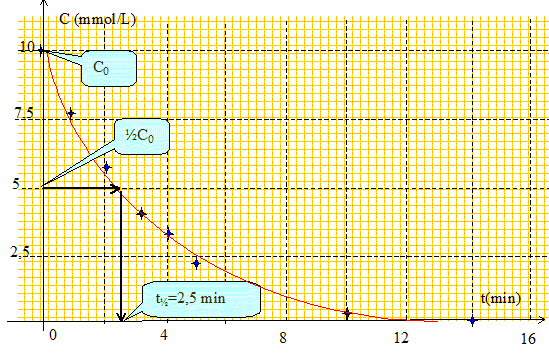
Dresser le tableau donnant C en fonction de t. C= C0(1-G/GM.).
Déterminer graphiquement le temps t½ de demi-réaction.
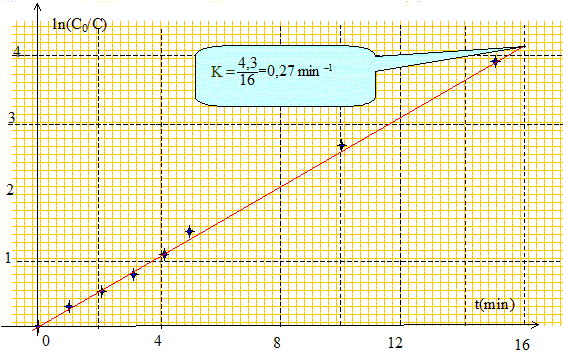
Tracer ln(C0/C) en fonction du temps. Déterminer le coefficient directeur K de la droite obtenue. Préciser l'unité de K.
En déduire l'expression littérale de C en fonction de C0, K et t. ln(C0/C) = Kt ; ln(C/C0) = - Kt ; C = C0 exp(-Kt). Montrer que la vitesse volumique de la réaction est de la forme v = KCa ; donner la valeur de a. v = -d[R-Cl] = -dC/dt ; dC/dt = -KC0exp(-Kt) = -KC d'où v = KC avec a=1. Etablir l'expression du temps de demi-réaction t½ en fonction de la constante de vitesse K puis le calculer. C = C0 exp(-Kt) ; ½C0 = C0 exp(-Kt½) ; ln 0,5 = -Kt½ ; ln 2 = Kt½ t½ =ln2/K = 0,693/0,27 = 2,6 min, du même ordre de grandeur que celui déterminé graphiquement. Calculer la vitesse volumique de la réaction aux dates t=0 et t=t½. v0 = KC0 = 0,27 *10 = 2,7 mmol L-1 min-1. vt½ = ½KC0 = 0,27 *5 = 1,35 mmol L-1 min-1.
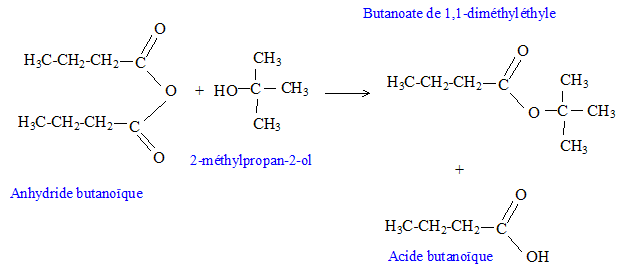
Donner le nom et la classe de l'alcool obtenu par hydrolyse du 2-chloro-2-méthylpropane. 2-méthylpropan-2-ol, alcool tertiaire. Quel isomère de cette alcool donne par oxydation ménagée de l'acide butanoïque. L'alcool primaire le butan-1-ol. On réalise cette oxydation ménagée par action d'une solution de permanganate de potassium en milieu acide. Ecrire l'équation de la réaction d'oxydoréduction. 4 fois {MnO4- + 8 H+ + 5 e- = Mn2+ + 4H2O }. 5 fois {C3H7-CH2OH + H2O = C3H7-COOH + 4 H+ + 4 e- }. 4 MnO4- + 12 H+ + 5 C3H7-CH2OH = 4Mn2+ + 5 C3H7-COOH + 11 H2O. Donner la formule développée de l'anhydride butanoïque. [ CH3-CH2-CH2-CO]2O. On fait réagir m1 = 63,2 g d'anhydride butanoïque avec m2 = 18,5 g de 2-méthylpropan-2-ol en présence d'acide sulfurique et on chauffe à reflux. Ecrire l'équation de la réaction. Donner les noms des produits obtenus.
Quel est l'intérêt d'utiliser l'anhydride butanoïque au lieu de l'acide butanoïque ? Estérifier un alcool tertiaire à partir de l'acide butanoïque ( mélange équimolaire) conduit à un rendement inférieur à 10 %. A partir de l'anhydride butanoïque le rendement est de 100 % ( réaction totale). Quelle masse d'ester obtient-on ? Masse molaire : anhydride éthanoïque : 12*8+3*16+14 = 158 g/mol Qunatité de matière d'anhydride : n1= m1 /M = 63,2/158 =0,4 mol Masse molaire du 2-méthylpropan-2-ol : 4*12+10+16 = 74 g/mol Quantité de matière d'alcool : n2= m2 /M =18,5/74 =0,25 mol L'alcool constitue le réactif limitant, on peut donc obtenir au mieux 0,25 mol d'ester. Masse molaire de l'ester : M = 144 g/mol mester = 0,25*144 = 36 g.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|