|
Concours manipulateur électroradiologie médicale Lyon 2008 acide monochloroacétique ; chromage : électrolyse ; précipitation ; acétate d'eugényle. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On prépare 1,00 L d'une solution aqueuse S d'acide monochloroacétique ClCH2-COOH. Le pKa du couple acide base associé est égal à 2,8 et le pH de la solution obtenue est 1,9. Lors du dosage d'un prélevement de 20,0 mL de la solution S par de l'hydroxyde de sodium telle que cb=0,50 mol/L, le volume équivalent mesuré est Véq=8,0 mL. La constante de la réaction de dosage est égale à 10-11,2. Faux. ClCH2-COOH + HO- = ClCH2-COO- + H2O. K = [ClCH2-COO-] / ([ClCH2-COOH ][HO-]) Or Ka = [ClCH2-COO-][H3O+] / [ClCH2-COOH ] soit [ClCH2-COO-] /[ClCH2-COOH ] =Ka /[H3O+] Repport dans K : K=Ka /([H3O+][HO-]) = Ka/Ke = 10-2,8/10-14 = 1011,2. A l'équivalence du dosage le pH est basique. Exact. A l'équivalence on a une solution de monoacétate de sodium ; la réaction prépondérante est : ClCH2-COO- + H2O = ClCH2-COOH + HO-. K' =1/K= 10-11,2. K' étant petit cette réaction est très limitée.
[ClCH2-COOH ] =[HO-] = xéq /0,028 Par suite K = 10-11,2 = x2éq /(0,028 n1) ; x2éq = 6,3 10-12*0,028* 4 10-3 ; d'où xéq = 2,65 10-8 mol ; [HO-] = 2,65 10-8 /0,028 =9,5 10-7 mol/L [H3O+] = 10-14 / 9,5 10-7 ~ 10-8 mol/L soit pH ~ 8. La concentration de la solution S est égale à 20 mmol/L. Faux. A l'équivalence 20 C = 8 cb ; C = 8/20*0,5 ; C= 0,2 mol/L = 200 mmol/L. m = n M = 0,2*94,5 =
18,9 g dissout dans
1 L.
On verse un volume V1 = 10 mL d'une solution aqueuse de chlorure de calcium( Ca2+aq + 2Cl- aq) de concentration c1 = 0,10 mol/L dans un volume V2=10 mL de solution de carbonate de sodium ( 2Na+aq + CO32-aq) de concentration molaire c2=0,10 mol/L. On observe la formation d'un précipité blanc de carbonate de calcium : Ca2+aq + CO32-aq = CaCO3 (s). Constante de cette réaction K = 108. Le quotient initial de réaction est supérieur à la constante d'équilibre. Faux. On observe la formation du précipité de carbonate de calcium : l'équilibre évolue dans le sens direct ; le principe d'évolution spontané conduit à : Qr i <K. Le quotient initial de réaction a pour valeur Qr i =100. Faux. Qr i = 1/([Ca2+aq]i[CO32-aq]i) [Ca2+aq]i = c1V1 / (V1 +V2) =0,10*10/20 = 0,05 mol/L. [CO32-aq]i= c2V2 / (V1 +V2) =0,10*10/20 = 0,05 mol/L. Qr i =1/ (0,05*0,05) = 1/(25 10-4) = 100*100/25 = 400. A l'équilibre, la concentration molaire en ion carbonate est [CO32-aq ]éq = 10-4 mol/L. Exact. K= 1/([Ca2+aq]éq[CO32-aq]éq)
soit [CO32-aq]éq= 1/K½ = 1/104 = 10-4 mol/L. Après passage à l'étuve du précipité, on obtient une masse de 100 mg. Exact. 50(10-3 -xéq) = 10-4 ; 10-3 -xéq = 10-4 /50 = 2 10-6 mol ; xéq =9,98 10-4 mol. M(CaCO3) = 40+12+3*16=100 g/mol m = xéq M = 9,98 10-4 *100 = 9,98 10-2 g = 99,8 mg.
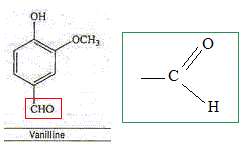
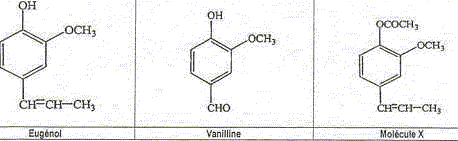
L'eugénol extrait de l'huile essentielle des clous de girofle, est utilisée dans certains produits des domaines médical et dentaire en raison de ses propriétés antalgiques et antiseptiques. On peut également l'utiliser pour réaliser l'hémisynthèse de la vanilline, molécule aromatique présente dans la vanille.
La vanilline est un ester de l'eugénol. Faux. La molécule de la vanilline
ne possède pas le groupe La vanilline possède une fonction aldehyde. Exact.
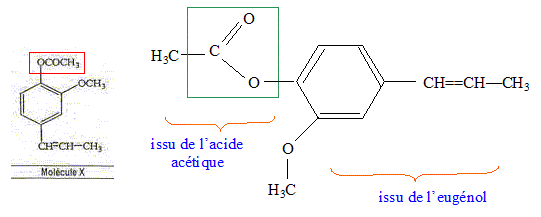
La molécule X est l'acétate d'eugényle. Exact.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
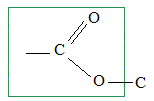 caractéristique
de la fonction ester.
caractéristique
de la fonction ester.