|
acide chlorhydrique ; ammoniaque ; cinétique chimique ; chimie organique concours contröleur répression des fraudes 2006 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On désire préparer une solution d'acide chlorhydrique de concentration " exacte " 0,1200 mol.L-1 à partir de la solution commerciale . Calculer la concentration C0 de la solution commerciale. Données : % massique 37 % ; densité d=1,19 ; M=36,46 g/mol. Masse de 1 L de solution commerciale : 1,19 kg = 1190 g Masse d'acide pur : m=1190*0,37 = 440,3 g Quantité de matière n = m/M =440,3 / 36,46 = 12,076 mol dans 1 L ( réponse c0 = 12 mol/L) Calculer le volume V0 de solution commerciale à prélever pour préparer un volume V = 200 mL de solution de concentration C= 0,120 mol.L-1 . On obtient la solution S Facteur de dilution : F = c0/C =12,076 / 0,120 = 100,63 Volume prélevé = volume V / F = 200/100,63 =1,987 mL ( réponse : V0 = 1,99 mL ) Étalonnage de la solution S. On réalise l'étalonnage de la solution préparée à l'aide de la substance étalon : hydrogénocarbonate de potassium par pesée simple en présence de bleu de bromophénol Écrire l'équation du dosage et calculer sa constante. Données : CO2,H2O / HCO3- pKa = 6,4. M(KHCO3) =M= 100,11 g/mol. H3O+ + HCO3- = CO2 dissout + 2H2O ; K = [CO2,H2O] / ([H3O+ ][HCO3- ]) Or CO2,H2O + H2O = HCO3- + H3O+ ; Ka = [H3O+ ][HCO3- ] /[CO2,H2O] K = 1/Ka = 106,4 = 2,5 106. Donner l'expression littérale de la concentration C en fonction de m : masse à peser, M, et Ve volume équivalent. Quantité de matière d'ion HCO3- : m/M Quantité de matière d'acide chlorhydrique à l'équivalence : C Ve. A l'équivalence m/M= C Ve ; C = m/(MVe). Calculer la masse à peser pour avoir un volume équivalent Ve environ égale à 15 mL. m = C VeM = 0,120*15 10-3*100,11 = 0,18 g. Quelle est la nature de la solution à l'équivalence ; Calculer son pH ; justifier le choix de l'indicateur coloré utilisé. Indicateur coloré Zone de virage Couleur Bleu de bromophénol 2,8 - 4,6 Jaune - bleu Rouge de méthyle 4,2 - 6,8 Rouge - jaune Bleu de bromothymol 6,0 - 7,6 Jaune - bleu Phenol phtaleine 8,3 - 10,0 Incolore - rose Solution aqueuse de chlorure de potassium + CO2 dissout.
4 10-7(0,12 -X) = X2 ; X2+4 10-7 X-4,8 10-8=0 ; X = 2,19 10-4 mol/L pH = - log (2,19 10-4) =3,7. La zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence : le bleu de bromophénol convient.
Masse pesée (g) Volume équivalent obtenu
(mL) m1 = 0,1755 V1= 14,55 m2 = 0,1932 V2= 15,90 C1 =m1 /(V1M)= 0,1755 /(100,11*14,55 10-3)=0,1205 mol/L.(0,120486) C2 =m2 /(V2M)= 0,1932 /(100,11*15,90 10-3)=0,1214 mol/L. (0,121376) La précision demandée est de 0,6%. Les résultats sont-ils concordants ? justifier la réponse. (C2-C1)/0,120 = 7,4 10-3 (0,74 %). Résultats non concordants.
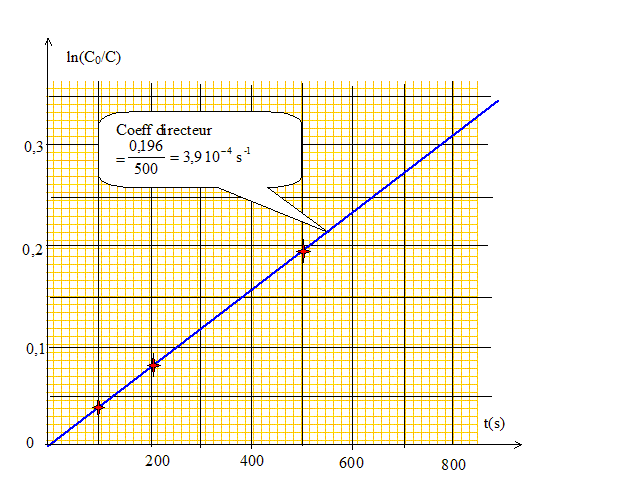
Cinétique. On étudie la cinétique de la réaction suivante : BrO3- + H+ +5 Br- = 3 Br2 + 3H2O On réalise l'expérience en présence d'un grand excès d'ions H+ et Br- pour pouvoir négliger la variation de leur concentration . On mesure la concentration en BrO3- en fonction du temps ; les résultats obtenus sont les suivants :
Établir dans le cas d'une réaction d'ordre 1, la relation entre la concentration d'un réactif et le temps t. vitesse de la réaction -d[BrO3-]/dt = k[BrO3-] d[BrO3-]/ [BrO3-] = -kdt ; d ln[BrO3-] = -kdt ; intégrer entre 0 et t: ln [BrO3-]- ln [BrO3-]0 = -kt ; ln ([BrO3-]0 / [BrO3-] ) = kt. Montrer que la réaction est d'ordre 1 par rapport à [BrO3- ].
Déterminer la constante de vitesse. k = 3,94 10-4 s-1. Déterminer le temps de demi réaction. à t = t½, [BrO3-]=0,5 [BrO3-]0 ; ln ([BrO3-]0 / [BrO3-] ) = ln 2 = k t½ ; t½= ln2 / k= 0,693 / 3,94 10-4 = 1,76 103 s.
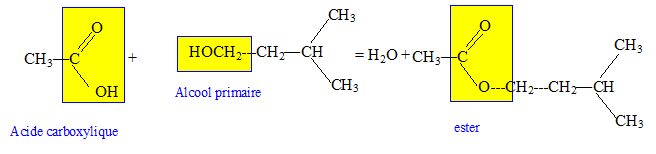
On désire réaliser la synthèse de l'éthanoate de 3-méthyl butyle (E) qui est utilisé comme arôme de poire dans certains sirops. Pour préparer (E) au laboratoire on fait réagir, à ébullition pendant une heure et en présence d'acide sulfurique, une masse m 1 = 53 g d'acide éthanoïque (A) et une masse m 2 = 33 g de 3-méthyl butan-1-ol (B)
Écrire l'équation de la réaction. Indiquer quels sont les groupements fonctionnels présents dans les molécules A, B et E.
Quelles sont les caractéristiques de cette réaction ? Lente, athermique, limitée par l'hydrolyse de l'ester. Quel est le rôle de l'acide sulfurique ? Catalyseur. Après purification on recueille un volume v = 36 cm3 de E. Quelle est la masse mE obtenue ? 1 mL d'ester a une masse de 0,87 g : mE = 36*0,87 =31,3 g. On désire rendre la réaction totale. Donner une méthode pour y parvenir. Remplacer l'acide éthanoïque par le chlorure d'éthanoyle ou l'anhydride éthanoïque. Quelle serait la masse m'E obtenue si la transformation était totale ? n(acide éthanoïque) =53/60 = 0,883 mol ; n(alcool) = 33/88 =0,375 mol, alcool en défaut. On peut obtenir au mieux 0,375 mol d'ester soit une masse de : 0,375*130=48,7 g.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|