|
Atomistique : ion moléculaire H2+ : concours technicien ministère des finances 02 |
|||||||||
|
|||||||||
Quelles sont leurs valeurs pour l'atome d'hydrogène pris dans son état de plus basse énergie ? n=1 ; l=0 ; m=0 ; s = ½ Soit l'ion moléculaire H2+ : L'énergie de liaison des nucléons est voisine de 257 kJ.mol-l. Rappeler la définition de l'électron-volt. (eV) Energie acquise par un électron partant du repos et accéléré par une tension de 1 V. 1 eV = 1,6 10-19 J.
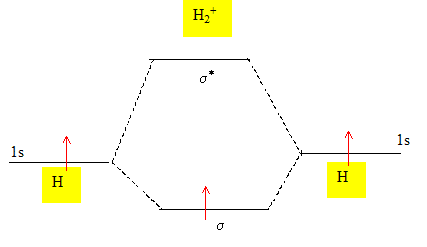
Représenter le diagramme des orbitales moléculaires de cet ion. Règles d'élaboration des diagrammes moléculaires : Les orbitale atomiques de même symétrie et d'énergie proche sont combinées. Il en résulte un nombre d'orbitale moléculaire (OM) égal au nombre d'orbitale atomique ( OA) de départ. * placer les OA des deux atomes de part et d'autre d'un espace destiné au tracé des OM. Si deux atomes ne sont pas identiques, les OA n'ont pas la même énergie : l'atome le plus électronégatif est celui dont les OA sont situées le plus bas. * connaître les liaisons :
* trouver les positions des OM par rapport aux OA :
Règles à respecter pour placer les électrons sur ce diagramme : Placer les électrons dans les niveaux de plus basse énergie. Remplir le maximum d'orbitales dégénérées avec un électron, puis constituer des doublets. Quel est l'indice de liaison ? Indice de liaison dans H2+ : 1 électrons dans les OM liantes et 0 dans les OM anti-liantes n = (1-0)/2 = 0,5.
|
|||||||||
|
|
|||||||||
|
|