|
électrolyse, estérification : éthanoate de menthyle EMIA 07 |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
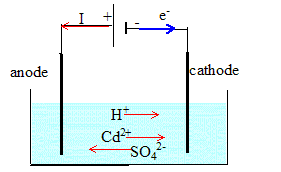
Le cadmium est un métal dont les utilisations sont aujourd’hui multiples : il est utilisé dans les colorants, entre dans la composition de nombreux alliages à bas point de fusion, mais il est principalement utilisé dans les revêtements anticorrosion et les électrodes des accumulateurs électriques. Il n’existe pas à l’état natif et la rareté de son minerai fait qu’il est préparé indirectement à partir de minerais de zinc dans lesquels il est présent. On se propose d’étudier ici la phase finale de cette production, qui est l’électrolyse d’une solution de sulfate de cadmium ( Cd2+ + SO42-) et d’acide sulfurique. L’électrolyse est réalisée à l’aide d’électrodes d’aluminium, la tension aux bornes du générateur étant de 3V et délivrant une intensité I de 20 kA. On supposera dans tout le problème que les électrodes et les ions sulfates ne participent pas aux différentes transformations physico-chimiques. Préciser les différentes espèces chimiques présentes dans la solution. Cd2+ ; SO42- ; H3O+ (apporté par l'acide sulfurique) , H2O. Faire le schéma de l’électrolyseur. Indiquer sur celui-ci le nom des électrodes, le sens du courant électrique et les sens de déplacement des ions.
Sur quelle électrode le cadmium se dépose-t-il ? Ecrire alors l’équation de la réaction à cette électrode. Réduction des ions Cd2+ à la cathode négative : Cd2+ + 2e- = Cd(s) On observe un dégagement gazeux à la surface de l’autre électrode. On donne les couples : Cd2+ / Cd(s) ; H+ / H2(g) ; O2(g) / H2O(l). En considérant les différents couples redox donnés, déterminer la nature du gaz formé. Oxydation de l'eau à l'anode en dioxygène. Ecrire alors l’équation de la réaction à cette électrode. H2O(l) = ½O2(g) +2H++2e-. Cd2+ +
H2O(l) = ½O2(g)
+2H++Cd(s). Donner l’expression littérale de la quantité d’électricité Q transportée dans l’électrolyseur au bout de d’un temps t de fonctionnement. Calculer Q en coulombs pour t = 10 heures. Q= It avec I en ampère et t en seconde. Q = 2 104*3600*10 =7,2 108 C. On rappelle que la charge électrique F d’une mole d électrons vaut 96500 C. Exprimer littéralement le nombre de moles d’électrons ne qui se sont déplacés dans le circuit pendant le temps t en fonction de Q et F. Q = ne F. Que vaut le nombre de moles de cadmium formées nCd en fonction de ne ? nCd =½ ne.
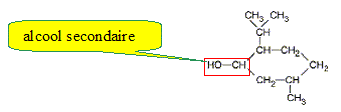
Préparation de l’éthanoate de menthyle. L’éthanoate de menthyle est une substance odoriférante, dérivée du menthol et qui entre dans la composition de nombreux parfums, notamment les eaux de lavande commerciales. Dans la nature, on le trouve dans l’huile essentielle extraite de la menthe poivrée et est difficilement isolable car associé à de nombreuses autres espèces. On se propose donc d’étudier ici une préparation de ce composé en laboratoire à partir d’acide éthanoïque et de menthol, lui-même obtenu par synthèse. La formule semi-développée de la molécule de menthol est donnée ci-dessous :
Quel est le nom de la fonction de cette molécule ? A l’aide des données du tableau, indiquer en expliquant, l’état physique de ce composé à la température ambiante de 20°C ?
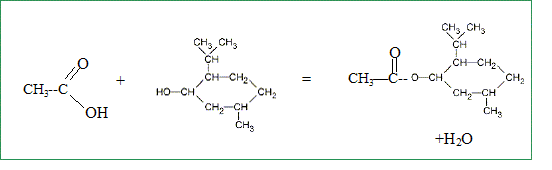
En utilisant les formules semi-développées, écrire l’équation de la réaction entre le menthol et l’acide éthanoïque. Quel est le nom d’une telle réaction ? Donner trois caractéristiques de ce type de réaction. Estérification, lente, athermique, limitée par l'hydrolyse de l'ester.
On introduit dans un ballon une masse de 15,6 g de menthol, puis, avec précaution, 12 g d’acide acétique pur, et enfin quelques gouttes d’acide sulfurique concentré et des grains de pierre ponce. On surmonte alors le ballon d’un montage de chauffage à reflux que l’on maintient pendant une heure, puis on refroidit le ballon. Calculer les nombres de moles de menthol et d’acide éthanoïque introduits dans le ballon. Quel est le réactif en excès ? n( acide acétique) = 12/60 = 0,2 mol ; n(menthol)=15,6 /156 = 0,1 mol 0,1 mol de menthol peut réagir avec 0,1 mol d'acide acétique d'après les nombres stoechiométriques de l'équation. L'acide acétique est donc en escès. En déduire la masse théorique d’éthanoate de menthyle si la réaction était totale. 0,1 mol d'ester. Indiquer les rôles respectifs du chauffage, du reflux et de l’acide sulfurique. L'acide sulfurique est un catalyseur. Le chauffage à reflux permet d'accélérer la réaction en travaillant à température modérée ; les vapeurs se condensent dans le réfrigérant et retombent dans le ballon, on évite ainsi les pertes de matière. Après refroidissement, le contenu du ballon est versé dans un bécher contenant de l’eau froide. On y observe deux phases non miscibles, l’une aqueuse, l’autre organique que l’on sépare dans une ampoule à décanter. Enfin, on réalise le lavage de la phase organique avec une solution saturée d’hydrogénocarbonate de sodium NaHCO3 pendant lequel on observe une effervescence. Finalement le rendement de la synthèse est de 60 %. Quel est le rôle du lavage ? Quel est le gaz responsable de l’effervescence et la cause de sa formation ? L'hydrogénocarbonate de sodium est une base : on élimine l'acide restant dans la phase organique : il se dégage du CO2. Calculer la masse expérimentale d’éthanoate de menthyle obtenue. 0,1*0,6 = 0,06 mol d'ester masse = quantité de matière (mol) * masse molaire (g/mol) m(ester) = 0,06*198 =11,9 g soit 12 g.
|
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|