|
Pile : sens d'évolution, composition finale du système ; conductivité : solution d'ammoniac concours kiné EFOM 2008 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
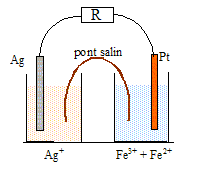
Les couples en présence sont Ag+(aq)/Ag(s) et Fe3+ (aq) / Fe2+(aq). La constante d'équilibre de la réaction Ag+(aq)+Fe2+(aq) =Fe3+ (aq) +Ag(s) vaut K = 3,1. L'électrode de platine n'intervient pas dans les réactions. Le volume des demi-piles est V=1,0 L. Déterminer le sens d'évolution du système, si initialement [Ag+]i = 0,10 mol/L ; [Fe2+]i = 0,010 mol/L ; [Fe3+]i = 0,020 mol/L. Quotient initial : Qr, i = [Fe3+]i / ([Ag+]i [Fe2+]i ) = 0,02 /(0,1*0,01) =2/0,1 = 20. Qr, i > K, le système évolue dans le sens indirect, de la droite vers la gauche. En déduire les réactions aux électrodes et le sens de circulation des électrons dans la résistance R. Fe3+ (aq)
+e- =
Fe2+(aq);
réduction de l'ion fer (III) sur le
platine. Les électrons se déplacent de
l'argent vers le platine dans le circuit
extérieur.
Exprimer la quantité de matière d'électrons ayant circulé dans le circuit en fonction de xf et du volume des demi-piles. Fe3+ (aq) +e- = Fe2+(aq). xf V mol d'ion fer (III) se réduit ; la quantité de matière d'électrons est xf V = xf mol car V=1 L. En déduire la quantité d'électricité ayant circulé. 1F~ 105 C. Q = quantité de matière d'électrons fois 1 faraday ; Q = xf * 105 =0,012 *105 = 1,2 103 C. Calculer la variation de masse de l'électrode d'argent. M(Ag)~110 g/mol. Ag(s) = Ag+(aq)+ e- : la masse d'argent diminue de xf mol. |Dm| = xf M(Ag) = 0,012*110 = 1,2*1,1 = 1,3 g.
Conductivité : solution d'ammoniac. On dissout 10-3 mol d'ammoniac NH3 aq dans 1 L d'eau. La conductivité de la solution obtenue est égale à 3,2 mS m-1. Déterminer la concentration initiale en ammoniac de la solution. [NH3 aq]i = n/V = 10-3 mol/L = 1 mol m-3. Ecrire l'équation de la réaction de l'ammoniac avec l'eau. Couples acide base : NH3 aq / NH4+ aq ; H2O /HO-aq. NH3 aq +H2O = NH4+ aq +HO-aq. Dresser le tableau d'avancement et déterminer l'avancement maximal.
En utilisant la valeur de la conductivité de la solution, calculer la concentration en ion hydroxyde de la solution. On néglige la conductiité due aux ions oxonium présents dans la solution. lNH4 + = 7,3 mS m2 mol-1 ; lHO- = 20 mS m2 mol-1. s = lNH4 +[NH4+ aq]f + lHO- [HO- aq]f avec [NH4+ aq]f =[HO- aq]f . s = (lNH4 ++ lHO-)[HO- aq]f ; [HO- aq]f = s / (lNH4 ++ lHO-) = 3,2 /(7,3+20) = 3,2 / 27,3 = 0,117 ~0,12 mol m-3 = 1,2 10-4 mol/L. Calculer l'avancement final xf de cette réaction. [HO- aq]f =xf/V avec V= 1 L ; xf = 1,2 10-4 mol Calculer le taux d'avancement final de cette réaction. t = xf/xmax = 1,2 10-4 / 10-3 = 0,12 ( 12%).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|