|
Dosage du diiode , liqueur de Dakin. Concours manipulateur électroradiologie médicale Corbeil 2008 |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
Partie A : L'iode existe sous plusieurs formes isotopiques comme 13153I, nucléide radioactif utilisé en médecine comme traceur et 12753I, non radioactif. Donner la composition des noyaux 13153I et 12753I. 13153I : 53 protons et 131-53 = 78 neutrons. 12753I : 53 protons et 127-53 = 74 neutrons. Définir le terme isotope. Même nombre de charge Z ( ou numéro atomique) mais des nombres de neutrons différents. L'iode appartient à la même famille que le fluor (F), le chlore (Cl) et le brome. Comment se nomme cette famille ? Halogènes.
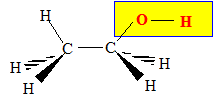
L'alcool iodé vendu en pharmacie est un
antiseptique. Il est préparé par
dissolution du diiode I2 dans une
solution alcoolique d'iodure de potassium. L'alcool utilisé lors de cette
dissolution est représenté ci-dessous
: CH3-CH2OH. Recopier cette
molécule et encadrer la fonction
caractéristique du groupe
alcool. alcool : groupe OH fixé sur un carbone
tétragonal.
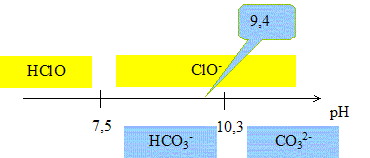
Liqueur de Dakin. La liqueur de Dakin est un mélange contenant : - de l'eau de Javel à 1,5 degré chlorométrique contenant les ions hypochlorite ClO-. - des ions hydrogénocarbonate HCO3- dont la concentration molaire apportée est 0,238 mol/L - des ions permanganate MnO4- qui assurent la coloration. Données : HClO/ HClO- pKa1 = 7,50 ; HCO3- /CO32- pKa2 = 10,3. Le pH de la liqueur de Dakin est 9,4. Calculer la concentration en ions oxonium et en déduire la concentration en ions hydroxyde dans la liqueur de Dakin. [H3O+] = 10-pH = 10-9,4 = 3,98 10-10 ~ 4,0 10-10 mol/L. Produit ionique de l'eau : [H3O+] [HO-]= 10-14 à 25°C. [HO-]= 10-14 /[H3O+] = 10-14 /3,98 10-10 ~2,5 10-5 mol/L. Calculer la constante d'équilibre associée au couple acide hypochloreux/ ion hypochlorite. HClO/ HClO- pKa1 = 7,50 ; Ka1 =10-pKa1 =10-7,5 =3,16 10-8~ 3,2 10-8. A partir d'un diagramme de prédominance, montrer que ce sont les espèces ClO-aq et HCO3- aq qui prédominent.
à pH >7,5 , l'ion Cl A pH >7,5 l'ion ClO- prédomine sur la forme acide HClO ; à pH<10,3, la forme HCO3- prédomine sur CO32- .
Une réaction acidobasique a lieu entre les ions HCO3- et HO- présents dans la liqueur de Dakin ( milieu basique). Ecrire l'équation de cette réaction. Couples acide / base : HCO3- /CO32- pKa2 = 10,3 ; H2O/HO- pKe = 10-14. HCO3- aq+ HO- aq = CO32- aq + H2O(l). Calculer la constante d'équilibre K associée à cette réaction. K= [CO32- aq] / ([HCO3- aq][HO- aq]) or Ka2 =[CO32- aq] [H3O+] / [HCO3- aq] soit [CO32- aq] / [HCO3- aq] = Ka2 /[H3O+] Repport dans l'expression de K : K= Ka2 /([H3O+][HO- aq]) = Ka2 / Ke. K = 10-7,5 / 10-14 = 106,5 =3,2 106.
|
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
|