|
Concours manipulateur électroradiologie médicale Clermond Ferrand 2008 radioactivité, travail, énergie cinétique et potentielle, acide base |
|||||||
|
|||||||
|
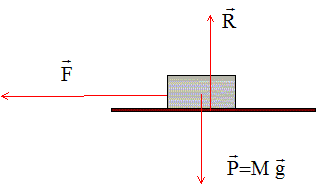
Distance parcourue par la lumière dans le vide à la vitesse c=3 108 m/s pendant une année. 1 an = 365,25*24*3600 ; T = 3,16 107 s. D= c T = 3 108 *3,16 107 = 9,46 1015 m = 9,46 1012 km. Quel est le travail du couple qu'il faut exercer pour tordre, d'un angle q, un fil dant la constante de torsion est C ? Expression d'un couple de torsion G = C q avec q en radian. Expression du travail élémentaire au cours de la torsion d'un angle très petit noté dq : dW = C q dq Intégrer entre 0 et q pour le travail au cours de la torsion d'un angle q : W = ½Cq2. Quelles sont dans le
système internationnal les unités de
force, de travail, de puissance et de vitesse
angulaire ? Force : newton (
N) ; travail :
joule (J) puissance : watt
(W) ; vitesse
angulaire : radian/seconde
( rad
s-1)
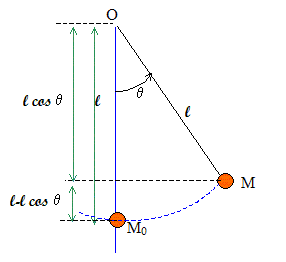
Un pendule simple est écarté de sa position d'équilibre d'un angle q =60°. L'objet suspendu, de masse m=200 g, est assimilable à un objet ponctuel ; la longueur du fil est L=1,6 m Calculer l'énergie potentielle du système terre pendule. Le plan horizontal contenant l'objet à la position d'équilibre sera choisi comme plan de référence de l'énergie potentielle de pesanteur.
Energie potentielle de pesanteur : Ep (M) = m g L( 1 - cosq). Ep (M) = 0,2 *10*1,6(1-cos60) = 1,6 J. Calculer la vitesse avec laquelle le pendule passe par la position d'équilibre. Energie mécanique du système au point le plus haut : 1,6 J Energie mécanique du système en M0 : ½mv2. Conservation de l'énergie mécanique : ½mv2 = 1,6 v =(3,2/m)½ =(3,2/0,2)½ = 4 m/s. Rappeler les définitions : d'un acide : espèce, ion ou molécule susceptible de céder un proton H+. du pH d'une solution aqueuse : le pH d'une solution aqueuse est défini à partir de la concentration en ion oxonium H3O+, exprimée en mol/L, par la relation : pH = - log [H3O+]. d'un acide fort en solution aqueuse : La réaction entre un acide fort et l'eau est totale : l'acide fort est entierement ionisé en solution aqueuse. de la constante d'acidité d'un couple acide base. Soit le couple acide / base AH/A- et le couple H3O+/H2O. Réaction acide base : AH + H2O = H3O++ A- . La consatant d'acidité est la constante d'équilibre de cette réaction : Ka = [H3O+][A-] /[AH]
Justifier ou réfuter les affirmations ci-dessous. La justification sera faite en 3 ou 4 lignes au maximum, puis illustrée par un exemple numérique si vous pensez que c'est vrai. La réfutation sera aussi justifiée en quelques lignes et sera appuyée par un contre exemple numérique, si vous pensez que c'est faux. A propos de solutions aqueuses de monoacides dont les concentrations sont comprises entre 10-1 et 10-5 mol/L, on énonce les affirmations suivantes : Dans le cas d'un acide fort la connaissance de la concentration est suffisante pour en déduire le pH. Vrai. L'acide fort est entièrement dissocié en solution. L'avancement final est égal à l'avancement maximal. [H3O+] = xmax/V = c, concentration en soluté apporté. Par suite pH = - log c. Exemple : acide chlorhydrique tel que c = 10-2 mol/L ; pH = - log c = - log 0,01 = 2. Entre deux acides celui dont la solution a le pH le plus faible, est le plus fort. Faux. Il faudrait préciser " à concentration égale ...." L'acide le plus fort correspond à l'acide le plus ionisé ( taux d'avancement final le plus proche de 1), c'est à dire libérant un plus grand nombre d'ion oxonium H3O+ en solution. Contre exemple : acide chlorhydrique, acide fort, à c = 10-3 mol/L : pH = 3. acide méthanoïque, acide faible : concentration 0,1 mol/L : pH= 2,4 concentration 10-3 mol/L : pH= 3,4. Données : acide méthanoïque / ion méthanoate Ka = 1,8 10-4. concentration 0,1 mol/L : pH= 2,4 concentration 10-3 mol/L : pH= 3,4.
|
|||||||
|
|
|||||||
|
|