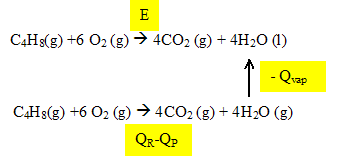|
acide lactique ; alcène ; énergie de liaison concours kiné Ceerrf 2008 |
|||||||
|
|||||||
|
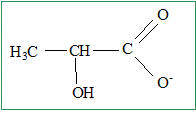
Il y a deux mois, un athlète a mesuré la concentration en acide lactique de son sang après un 800 m. Elle était de 1,90 g/L. Aujourd'hui il veut se refaire tester dans les mêmes conditions. On lui prélève V = 1,00 mL de sang et on en extrait la totalité de l'acide lactique. Cet acide est introduit dans une fiole jaugée de 50,0 mL contenant un peu d'eau distillée. On agite jusqu'à dissolution complète. On complète la fiole jaugée avec de l'eau distillée jusqu'au trait de jauge. On appelle S la solution obtenue. On réalise le dosage du volume V1 = 50,0 mL de la solution S par une solution aqueuse de soude de concentration molaire c1 = 1,00 10-3 mol/L. L'équivalence est atteinte pour un volume de solution de soude VE= 20,0 mL. On donne la constante d'équilibre de la réaction entre les ions hydroxydes et l'acide lactique : K= 1,3 1010 à 25°C. Ecrire la formule semi-développée de la base conjuguée de l'acide lactique.
Ecrire l'équation de la réaction de dosage. CH3-CHOH-COOH + HO- = CH3-CHOH-COO- + H2O. pKe =
14.
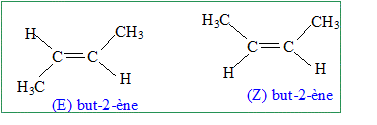
Hydrocarbure gazeux. On considère un alcène gazeux, noté A, de masse molaire MA= 56,0 g/mol. Données : Vm = 22,4 L/mol ; masse molaire de l'éthane M= 30,0 g/mol. En déduire sa formule brute. Formule brute d'un alcène : CnH2n avec n entier. MA = 12 n + 2n = 14 n = 56 d'où n =4 ; C4H8. On mélange une certaine quantité de cet alcène avec de l'éthane de manière à avoir un volume gazeux V= 3,36 L dans les conditions normales de température et de pression. On ajoute à ce mélange gazeux une masse m = 0,20 g de dihydrogène. En présence de platine, il se produit une réaction qui, une fois terminée, laisse un volume gazeux V' = 4,48 L dans les mêmes conditions de température et de pression. Ecrire l'équation de la réaction qui a eu lieu en utilisant les formules brutes. C4H8 + H2 = C4H10. Montrer que l'hydrogène a été introduit en excès. Quantité de matière (mol) du mélange initial éthane et alcène : volume (L) / volume molaire (L/mol) n = V/Vm = 3,36/22,4 = 0,15 mol. n(H2) = m/M(H2) = 0,2/2 = 0,1 mol. On note : a : quantité de matière éthane ; b : quantité de matière alcène. a+b = 0,15 (1). Quantié de matière finale éthane + autre(s) gaz = V'/Vm = 4,48/22,4 = 0,20 mol. A partir de b mol d'alcène on obtient b mol d'un alcane C4H10 : a+b +nH2 fin = 0,2 soit nH2 fin =0,05 mol ( excès H2) et nH2 ayant réagi avec b = b =0,05 mol. Déterminer la composition massique du mélange initial d'hydrocarbures. b = 0,05 mol d'alcène soit 0,05*56 = 2,8 g. a = 0,1 mol d'éthane C2H6 soit 0,1*30 = 3 g. L'hydratation de l'alcène a conduit à la formation d'un seul alcool. En déduire la formule semi-développée de l'alcène et son nom. Cet alcène donne t-il lieu à une isomérie de type Z E ? Si oui donner les formules semi-développées des isomères et les nommer, si non justifier. "Un seul alcool" : les deux atomes de carbone doublement liés portent donc les mêmes substituants.
On considère la réaction de combustion de cet alcène A en présence de dioxygène en excès. Notons E l'énergie molaire de combustion de A, c'est à dire l'énergie dégagée par la combustion d'une mole de cet alcène . On précise que pour la combustion d'une mole de cet alcène , l'énergie de liaison des réactifs à l'état gazeux vaut QR= 7611 kJ et l'énergie de liaison des produits à l'état gazeux est QP= 10136 kJ . L'énergie de cohésion de l'eau liquide, c'est à dire l'énergie qu'il faut fournir pour réaliser la vaporisation d'une mole d'eau liquide, est égale à Qvap = 41 kJ mol-1. Ecrire l'équation de combustion en considérant que l'eau formée est à l'état liquide. Etablir l'expression de E en fonction des données.
E = QR-QP-Qvap. Calculer l'énergie dégagée par la combustion de 5,6 g de l'alcène A. E = 7611-10136-41 = -2566 kJ/mol. 5,6 / 56 = 0,1 mol d'alcène d'où : -2566*0,1 = -256,6 kJ ~ -257 kJ.
|
|||||||
|
|
|||||||
|
|