|
Biocarburants ; transesterification ; pôts catalytiques ; pluies acides Concours Caplp externe 2008 |
|||||||
|
|||||||
|
Cette molécule est-elle chirale ? Justifier. Cette molécule possède un atome de carbone asymétrique : ( carbone tétragonal portant 4 substituants différents). Elle est chirale. Combien d'isomères de configuration présente cette molécule ? R1 et R2 possèdent une liaison double C=C, R3 possède deux liaisons double C=C : ajouter à cela le carbone symétrique, on peut s'attendre à 16 isomères de configuration. Deux énantiomères issus de la même molécule, on-ils : les mêmes propriétés chimiques, physiques, biologiques ? Mêmes propriétés chimiques, mêmes propriétés physiques ( sauf action sur la lumière polarisée), propriétés biologiques différentes ( les formes R et S d'une molécule ( un médicament ), peuvent avoir des effets physiologiques différents voire antagonistes ). Un acide gras, comme l'acide oléique CH3-(CH2)7-CH=CH-(CH2)7 -COOH est présent en quantité importante dans les plantes oléagineuses. Représenter sa configuration Z.
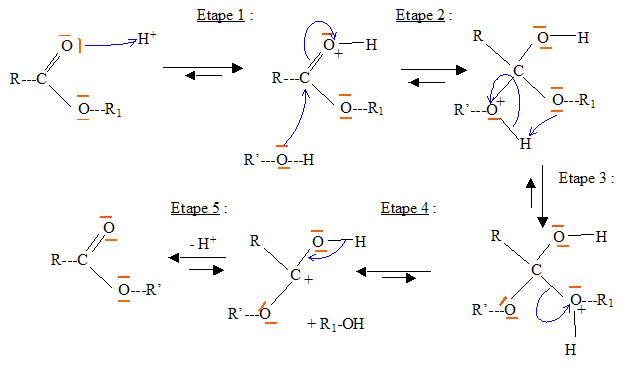
Donner la nomenclature de cette molécule sachant qu'un alcane constitué d'une chaine à 18 atomes de carbone est un octadécane. acide (Z) octadéc-9-ènoïque. Justifier que deux isomères de configurations Z et E sont appelés diastéréoisomères. La stéréoisomérie résulte uniquement de la position relative des atomes d'une molécule. L isomérie géométrique autour d'une liaison double ( Z, E) porte le nom de diastéréoisomérie. Expliquer pourquoi la liaison p empêche la libre rotation autour de la liaison C=C. Liaison p : recouvrement latéral des orbitales : les 2 lobes des deux orbitales en interaction sont parallèles ; ce type de liaison entraîne une rigidité moléculaire supprimant la libre rotation autour de cette liaison. Ester 1 + alcool = Ester 2 + autre alcool. Ecrire
l'équation de la transestérification
entre l'ester 1 noté R-COO-R1 et
l'alcool noté R'OH, en milieu acide, en y
indiquant les sites réactifs, les
différentes étapes ainsi que les
mécanismes
réactionnels. étape 1 : protonation du
carbonyle étape 2 : attaque
nucléophile sur le site
électrophile. étape 3 : départ de
R1-OH ; étape 4 :
déprotonation.
Lorsqu'on analyse les gaz d'échappement d'un véhicule, on trouve aussi des traces de CO, d'hydrocarbures et de NOx. Expliquer la provenance de l'oxyde de carbone et des oxydes d'azote. CO : combustion incomplète du carburant ; NOx : l'air contient du diazote. Déterminer le nombre d'oxydation de l'azote dans N2O, NO et NO2. N2O : 2 n.o(N ) -2 = 0 ; n.o(N) = +1 ; NO : n.o(N ) -2 = 0 ; n.o(N) = +2 ;NO2 : n.o(N ) -2*2 = 0 ; n.o(N) = +4 ; Pour diminuer l'émission de ces molécules nocives, l'utilisation du pôt catalytique dans les véhicules est obligatoire. Quel est l'effet d'un catalyseur sur une réaction chimique ? Justifier. Un catalyseur augmente la vitesse d'une réaction ; il participa à la réaction mais ne figure pas dans le bilan. La barrière enthalpie libre est plus basse en suivant un autre chemin réactionnel. S'agit-il d'une catalyse homogène ou hétérogène ? Justifier. Catalyseur solide ; réactifs gazeux : donc catalyse hétérogène. Un catalyseur peut-il rendre possible une réaction thermodynamiquement impossible ? Non. Ecrire, compléter et équilibrer les réactions d'oxydoréduction qui se passe à l'intérieur d'un pôt catalytique. a, b, c, d, e, f, g, h, i, j, k sont des nombres réels et les pointillés les produits de la réaction. a CO + bO2 = c .... d C2H6 + e O2 = f CO2 + g .... h NO + i CO = j .... + kCO2. 2CO + O2 = 2 CO2 ( O2 est l'oxydant ; CO est le réducteur ) 2 C2H6 + 7 O2 = 4CO2 +6 H2O ( O2 est l'oxydant ; C2H6 est le réducteur ) 2NO + 2 CO =N2 +2CO2 ( NO est l'oxydant ; CO est le réducteur ) Identifier et indiquer pour chaque réaction , l'oxydant et le réducteur.
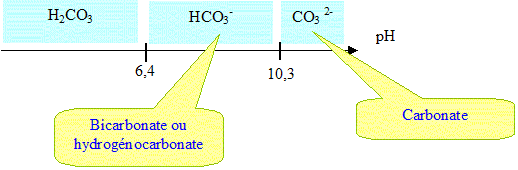
Il reste un inconvénient majeur pour l'environnement, le fort taux de CO2. Pourquoi l'émission de CO2 est-elle néfaste pour l'environnement ? CO2 est un gaz à effet de serre : il contribue au réchauffement global. Justifier pourquoi l'utilisation des plantes peut palier à cette émission de CO2 ? Lors de leur croissance, les plantes absorbent du CO2 ; lors de la combustion des biocarburants, il y a émission de CO2 : le bilan en CO2 est donc nul. En classe, comment caractérise t-on la présence de ce gaz lors d'une réaction chimique ? Le dioxyde de carbone trouble l'eau de chaux. Placer sur un axe gradué en unité pH, les espèces prédominantes des deux couples auquels appartient l'ion hydrogénocarbonate. CO2,H2O / HCO3- pKa1 = 6,4 ; HCO3- / CO32- pKa2 = 10,3.
Le dioxyde de carbone réagit avec l'eau. Ecrire les équations chimiques, en détaillant les constantes d'équilibre correspondantes. Que peut-on en déduire à pH=6,4 et à pH= 10,3 ? CO2,H2O+ H2O = HCO3- + H3O+ ; K =Ka1 =[HCO3-][H3O+] / [CO2,H2O]=10-6,4 : réaction très limitée, en milieu acide CO2 réagit peu avec l'eau. HCO3-+ H2O = CO32- + H3O+ ; Ka2 =[CO32-][H3O+] /[HCO3-] =10-10,3. H3O+ +HO- = 2H2O Ke = 10-14. d'où : CO2,H2O +2HO- = CO32- +2H2O K = [CO32-] / ([CO2,H2O][HO-]2) =Ka1 Ka2 / Ke2 = 10-6,4 .10-10,3.1028 =1011,3. réaction ttotale, en milieu basique CO2 réagit totalement avec l'eau. Conclure quant au pH de l'eau pure. La réaction limitée de CO2 avec l'eau distillée pure donne un milieu légerement acide. Décrire et schématiser une expérience permettant de doser les ions hydrogénocarbonate d'une eau minérale. Titrage par l'acide chlorhydrique en présence de bleu de bromophénol (zone de virage [ 3,6 - 5 ]) couples acide base : CO2,H2O / HCO3- ; H3O+ /H2O HCO3- +H3O+ =2H2O + CO2.
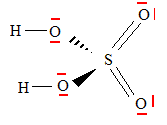
Ecrire la configuration électronique de l'atome de soufre. 1s2 2s2 2p6 3s2 3p4. Représenter le schéma de Lewis de la molécule d'acide sulfurique.
Déterminer la valence de l'atome de soufre dans H2SO4 et la comparer à celle du soufre dans H2S. Justifier la différence. La valence du soufre est 6 dans H2SO4 ( participation des orbitales 3 d vacantes ) et seulement 2 dans H2S. Pour former l'acide sulfurique, deux réactions successives se produisent : la formation de trioxyde de soufre à partir de l'oxydation du dioxyde de soufre par le dioxygène de l'air, puis la formation d'acide sulfurique par hydratation du trioxyde de soufre. Ecrire et équilibrer les équations des deux réactions décrites ci-dessus. SO2 + ½O2 = SO3 ; SO3+ H2O =H2SO4. Décrire une expérience, réalisée en classe, permettant d'identifier la présence d'ion sulfate dans une eau minérale. L'ion sulfate, en présence d'ion baryum Ba2+ donne sun solide blanc, le sulfate de baryum. Les pluies acides sont responsables de la corrosion des gouttières en zinc. Déterminer dans ce type de corrosion les couples oxydant / réducteur en présence. Zn2+/Zn et H3O+ /H2. Ecrire les demi-équations électroniques et l'équation bilan. Zn = Zn2++ 2e- ; 2H3O+ + 2e- = H2 + 2H2O Zn +2H3O+= Zn2++ H2 + 2H2O Proposer un autre métal pour fabriquer les gouttières de façon à ne plus avoir ce phénomène de corrosion. Cuivre ; aluminium ( recouvert d'une couche d'alumine protectrice) |
|||||||
|
|
|||||||
|
|
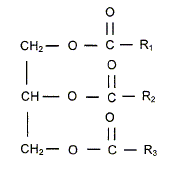
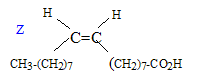
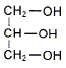 et des eters
méthyliques.
et des eters
méthyliques.