|
sucres : propriétés ; dosage du glucose dans un jus d'orange concours Caplp interne 2008 |
|||||||
|
|||||||
|
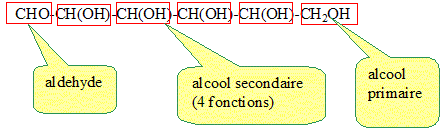
Le glucose a pour formule semi-développée : CHO-CH(OH)-CH(OH)-CH(OH)-CH(OH)-CH2OH Nommer les fonctions chimiques et les groupes caractéristiques présents dans le glucose.
Indiquer, à l'aide d'un astérisque, les atomes de carbone asymétriques. CHO-*CH(OH)-*CH(OH)-*CH(OH)-*CH(OH)-CH2OH. Indiquer le nombre de stéréoisomères correspondant à cette formule. 4 carbone asymétrique ; 24 = 16 stéréoisomères( isomères optiques) possible. Le fructose est également nommé : 1, 3, 4, 5, 6-pentahydroxohexan-2-one. HOCH2-CO-CH(OH)-CH(OH)-CH(OH)-CH2OH C6H12O6. Le glucose et le fructose sont deux isomères. Préciser le type d'isomèrie et justifier. Isomères de fonction : le glucose possède une fonction aldehyde, le fructose possède une fonction cétone
Titrage du glucose contenu dans un jus d'orange. En milieu basique et froid le glucose R-CHO est oxydé en ion gluconate R-COO- par le diiode en excès ; dans ces conditions le saccharose n'est pas oxydé. L'excès de diiode est dosé par le thiosulfate de sodium. En milieu acide, à chaud, le saccharose C12H22O11 est hydrolysé en glucose et fructose. Après retour en milieu basique, on peut doser la totalité du glucose. Solution S0, concentration C0 : 10,0 mL de jus d'orange est dilué dans une fiole jaugée de 50,0 mL. Oxydation du glucose libre : dans un erlenmeyer mettre 20,0 mL de S0, 25,0 mL de diiode ( C1 =5,0 10-2 mol/L) ; 5 mL de solution tampon pH=10. Titrage de l'excès de diiode : ajouter 5 mL d'acide chlorhydrique à 2 mol/L, titrer par le thiosulfate de sodium à C2 = 5,0 10-2 mol/L. On trouve Véq = 24,2 mL. Solution S'0, ajouter 5 mL d'acide chlorhydrique ( 2 mol/L) au contenu d'une ampoule de jus d'orange pour bébé. Chauffer à reflux durant 30 min. Ajouter 5 mL de soude à 2 mol/L afin que le pH de la solution soit sensiblement neutre. Transvaser dans une fiole jaugée de 50,0 mL et compléter avec de l'eau distillée. Titrer comme ci-dessus 20 mL de S'0. V'éq = 21,8 mL. Ecrire la relation entre la concentration molaire du glucose notée CG dans l'ampoule de jus d'orange et C0. "10,0 mL de jus d'orange est dilué dans une fiole jaugée de 50,0 mL" Le facteur de dilution est : F =50/10 = 5 d'où : CG= 5 C0. Quel est le nom de la famille des éléments contenant l'iode ? Halogènes. Représenter le modèle de Lewis l'atome d'iode et la molécule de diiode.
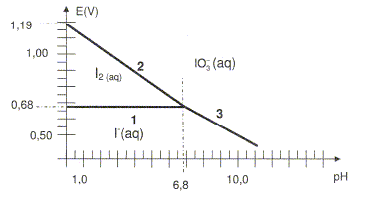
Le diagramme potentiel è pH simplifié de l'iode est donné ci-dessous :
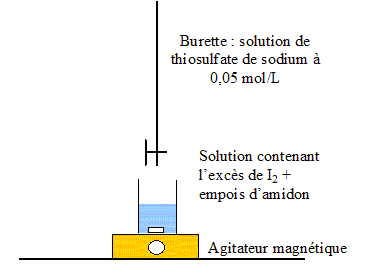
La concentration totale maximale est égale à 0,10 mol/L. On néglige la présence de I3-. Ecrire les demi-équations redox correspondant aux segments 1, 2et 3. (1) couple I2(aq) / I- (aq) : 2I- = I2 + 2e-. E°(I2(aq) / I- (aq)) = 0,68 V (2) couple I2(aq) / IO3- (aq) : I2 +6H2O=2 IO3- + 12 H+ + 10e-. E°(IO3-(aq) /I2 (aq)) = 1,19 V (3) couple I- (aq) / IO3- (aq) : I- +3H2O= IO3- + 6 H+ + 6e-. Calculer E°(I2/I-). E1 = E°(I2(aq) / I- (aq)) + 0,03 log([I2]/[I-]2) sur la ligne frontière (1) : [I2]=[I-] d'où E1 = E°(I2(aq) / I- (aq)) = 0,68 V ( lecture graphe) Calculer E°(IO3-/I-). E3= E°(IO3-(aq) /I- (aq)) +0,01 log([IO3-][ H+]6 / [I- ]) sur la ligne frontière (3) : [IO3-] =[I- ] d'où E3= E°(IO3-(aq) /I- (aq)) + 0,01log [ H+]6 E3= E°(IO3-(aq) /I-(aq)) +0,06 log [ H+] = E°(IO3-(aq) I- (aq)) -0,06 pH à pH=6,8 : E3 = 0,68 V ( lecture graphe) 0,68= E°(IO3-(aq) /I- (aq))-0,06*6,8 ; E°(IO3-(aq) /I- (aq))=0,68 + 0,06*6,8 = 1,09 V. Ecrire la réaction de dismutation du diiode en milieu basique. Il y a dismutation en milieu basique de I2 ( espèce colorée en jaune brun) en ion iodure et en ion IO3- , espèces incolores. d'une part : 5 fois { I2 + 2e- = 2I- } réduction d'autre part : I2 + 12 HO- = 2 IO3- + 6 H2O + 10e-. oxydation 6 I2 + 12 HO- = 2 IO3- +10 I- + 6 H2O oxydo-réduction. En milieu acide, la couleur jaune brune du diiode réapparaît. Donner le nom de la réaction mise en évidence et écrire son équation. rétrodismutation ou amphétorisation : IO3- + 5I- + 6 H+= 3I2 + 3H2O Faire un schéma légendé du montage nécessaire au titrage de la solution.
Quel est le rôle de l'empois d'amidon ajouté au cours du dosage ? Indicateur coloré de fin de réaction. Ecrire l'équation de la réaction entre I- et S2O32-. couple I2/I- : I2 +2e- = 2I-; couple S4O62-/ S2O32- : 2 S2O32- =S4O62-+2e-. I2 +2 S2O32- =S4O62-+2I-. Calculer le nombres de moles de diiode reformées et dosées. A l'équivalence : n(I2) = ½ n(S2O32-) = ½ C2 VE=0,5* 5,0 10-2 * 24,210-3 =6,05 10-4 mol .
Par soucis de simplification, en milieu basique, l'équation d'oxydation du glucose R-CHO en ion gluconate R-COO- peut s'écrire en faisant intervenir le diiode : I2 +R-CHO + 3HO- = 2I- + R-COO- + 2H2O. On note C0 la concentration en glucose libre dans la solution S0. Etablir la relation : C0 =( C1V1-0,5C2VE)V0. Appliquer la conservation de la quantité de matière en diiode. Quantité de matière initiale de diiode dans l'erlenmeyer : V1C1 Quantité de matière de diiode en excès : 0,5C2VE Quantité de matière de diiode ayant réagit avec le glucose libre : n(I2) =C1V1-0,5C2VE). I2 +R-CHO + 3HO- = 2I- + R-COO- + 2H2O. n(I2) = n(R-CHO) = C0V0 d'où : C0 =( C1V1-0,5C2VE)V0. Calculer C0. V1C1 =25*0,05=1,25 mmol ; ½ C2 VE= 0,605 mmol ; V0 = 20 mL. C0 =(1,25-0,605) / 20 = 3,2 10-2 mol/L.(3,225 10-2) En déduire la concentration massique (g/L) du glucose contenu dans le jus d'orange. CG = 5 C0 = 5*3,225 10-2 = 0,1612 mol/L puis 0,1612*180 = 29 g/L. Afin de titrer le glucose total contenu dans l'ampoule de jus d'orange on procède à l'hydrolyse acide du glucose. En milieu acide et à chaud, le saccharose s'hydrolyse en glucose et fructose. Ecrire l'équation de la réaction. C12H22O11 + H2O = C6H12O6 + C6H12O6 . Dans ces conditions le fructose n'est pas oxydé par le diiode. Déterminer la valeur de la concentration totale C'0 de la solution en glucose. C'0 =( C1V1-0,5C2V'E)V0. V1C1 =25*0,05=1,25 mmol ; ½ C2 V'E=0,5* 5,0 10-2 * 21,8 =0,545 mmol ; V0 = 20 mL. C'0 =(1,25-0,545) / 20 = 3,5 10-2 mol/L. (3,525 10-2) En déduire la valeur de la concentration massique ( g/L) du saccharose dans le jus d'orange. 3,525 10-2-3,225 10-2 = 3 10-3 mol/L de saccharose ; tenir compte de la dilution : 5*0,003 = 0,015 mol/L M(C12H22O11)=342 g/mol ; 0,015*342 = 5,1 g/L.
|
|||||||
|
|
|||||||
|
|