|
acide aminé : structure, propriétés acido-basiques Capes agricole 2008 |
|||||||
|
|||||||
|
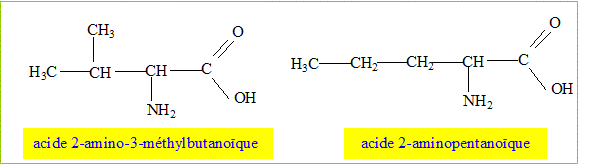
Il faut exactement une masse m de B pour doser un volume Va d'une solution d'acide chlorhydrique de concentration molaire Ca. Données : m=1,46 g ; Va= 20,0 mL ; Ca = 1,00 mol/L. Etablir la formule brute de A et donner les formules semi-développées possibles pour A. A l'équivalence les quantités de matière d'acide et de base sont en proportions stoechiométriques. CaVa = 20 10-3*1 = 2 10-2 mol ; nB = 2 10-2 = m/MB ; MB= m/2 10-2 = 1,46/0,02 = 74 g/mol. MB = M(R) + 12+14+4 soit M(R) = 43 g/mol ; on identifie R à C3H7. Formule brute de A : C3H7- CH NH2-COOH.
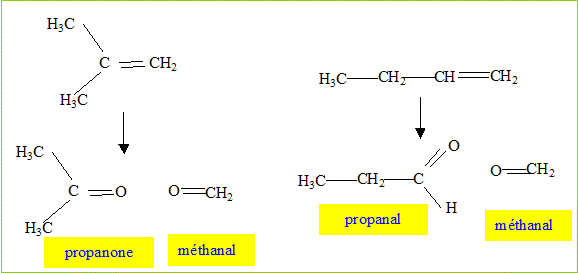
C subit une ozonolyse réductrice.
On obtient, entre autres composés,
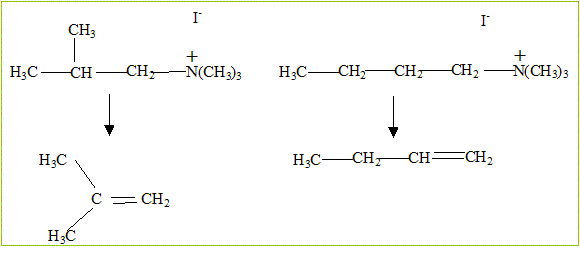
l'acétone. Travailler à chaud en présence d'une base forte Ag2O. Une élimination de type E2 conduit à l'alcène le moins substitué. Ecrire le bilan de la trialkylation, puis de l'élimination d'Hoffman en donnant les différentes possibilités pour C.
On identifie A à l'acide 2-amino-3-méthylbutanoïque.
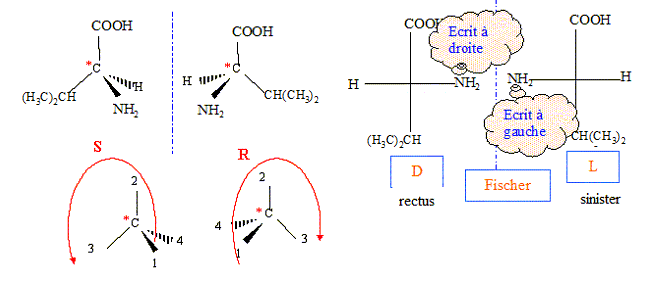
Représenter les différents stéréoisomères de A. Déterminer la configuration absolue de l'atome de carbone asymétrique ; préciser l'ordre de priorité des groupes substituants portés par l'atome de carbone asymétrique. Préciser pour chaque stéréoisomère à quelle série, D ou L, appartient l'acide aminé. Justifier. numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. NH2 (1) ; COOH (2) ; CH(CH3)2 (3) ; H (4). On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S). Lévogyre : qui a la propriété de faire dévier le plan de polarisation de la lumière polarisée dans le sens inverse des aiguilles d’une montre. (vers la gauche)
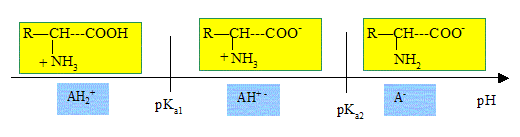
On trouve dans les tables pour un grand nombre d'acides a-aminés deux valeurs de pKa. A quelles fonctions peut-on attribuer ces deux pKa ? groupe amine et groupe acide carboxylique. Indiquer sur un diagramme de prédominance les formes majoritaires d'un acide a-aminé.
Le pH isoélectrique correspond à une valeur particulière du pH d'une solution d'acide aminé. Citer des propriétés de la solution à cette valeur du pH. Comportement amphotère de la solution. Grande solubilité de l'acide aminé dans l'eau. Etablir l'expression de ce pH et calculer sa valeur si pKa1 = 2,3 et pKa2 = 9,7. Point isoélectrique : pH pour lequel la charge totale de la molécule est nulle ; de plus les concentrations des formes AH2+ et A- sont identiques. AH2+ +H2O = AH+ -+ H3O+ ; Ka1 = [AH+ -] [H3O+] / [AH2+] AH+ - +H2O =A- + H3O+ ; Ka2 = [A- ] [H3O+] / [AH+ -] Ka1 Ka1 =[A- ][H3O+]2 /[AH2+] Or [A- ] =[AH2+] d'où : Ka1 Ka1 =[H3O+]2 ; pH=½(pKa1+pKa2). pH = 0,5(2,3+9,7) = 6.
|
|||||||
|
|
|||||||
|
|