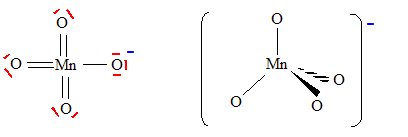|
Potentiométrie : dosage des ions fer II ; Capes agricole 2008 |
|||||||
|
|||||||
|
On verse dans cette solution une solution concentrée de dichromate de potassium de concentration telle que le volume de dichromate de potassium puisse être négligeable devant le volume V. Pour un tel titrage, on utilise une solution de sel de Mohr. Que contient cette solution et quel est l'intérêt d'utiliser le sel de Mohr ? (NH4)2 Fe (SO4)2, 6H2O. Les ions Fe2+ du sel de Mohr sont moins facilement oxydés par l'air que les même ions issus de FeSO4. Ces deux solutions libèrent la même quantité d'ion fer II. Quelles électrodes peut-on utiliser pour suivre ce titrage ? Justifier. L'électrode de référence utilisée ici est une électrode au calomel saturée (ECS), c'est à dire une électrode de platine (Pt) recouverte de mercure (Hg) sur lequel est déposé du calomel Hg2Cl2. Cette électrode est dite saturée car la solution dans laquelle plonge l'électrode ainsi constituée est une solution aqueuse saturée en chlorure de potassium KCl. L'électrode de mesure ( platine) doit être inattaquable en milieu acide ( pH=0). Réduction de l'ion dichromate :
Cr2O72- +14
H+ +6e- =2 Cr3+ +
7H2O.(1) Oxydation de Fe2+ : Fe2+ =
Fe3+ + e-
(2) Cr2O72- +14 H+ +6e- +6Fe2+ =2 Cr3+ + 7 H2O+ 6Fe3+ + 6e- Cr2O72- +14 H+ +6Fe2+ = 2 Cr3+ + 7 H2O + 6Fe3+. (3) K = [Cr3+ ]2 [ Fe3+ ]6 / ([ Fe2+ ]6[Cr2O72-][H+]14) Etablir l'expression littérale de la constante d'équilibre K en fonction des potentiels redox standard et déterminer sa valeur à 25°C.
Calculer la quantité de matière d'ion dichromate de potassium qu'il faut ajouter pour atteindre l'équivalence. Cr2O72- +14 H+ +6Fe2+ = 2 Cr3+ + 7 H2O + 6Fe3+. (3) d'après les nombres stoechiométriques, à l'équivalence, n(Fe2+) = 6 n(Cr2O72-) n(Cr2O72-) = n(Fe2+) /6 = a/ 6 =3 10-3 /6 =5 10-4 mol.
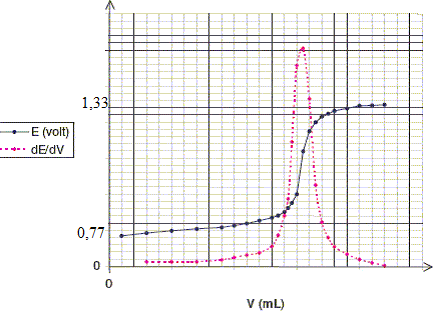
Calculer le potentiel d'oxydoréduction ( par rapport à l'ESH) prise par l'électrode de platine plongeant dans la solution à l'équivalence. Conservation de l'élément fer : [Fe2+]+[Fe3+] = a /V à l'équivalence [Fe2+] négligeable d'où : [Fe3+] = a /V = 3 10-3 / 0,1 = 3 10-2 mol/L. à l'équivalence n(Cr3+) = 2 n(Cr2O72-) ajouté = 10-3 mol/L ; [Cr3+]= 10-2 mol/L. Cr2O72- , Fe2+, négligeables à l'équivalence. A l'équivalence on mesure le potentiel, peu stable, du couple Fe3+ /Cr3+ Eéq =[6 E°(Cr2O72- / Cr3+)+ E°(Fe3+/Fe2+)]/7 Eéq =( 6*1,33+0,77) / 7 = 1,25 V. Donner l'allure de la courbe obtenue. Comment repère t-on l'équivalence ? Avant l'équivalence l'ion dichromate est en défaut ; le couple (Fe3+/Fe2+) fixe le potentiel. Après l'équivalence, l'ion fer II est en défaut ; le couple (Cr2O72- / Cr3+) fixe le potentiel.
On repère l'équivalence par la méthode des tangentes ou en traçant la courbe dE/dV : celle-ci présente un pic à l'équivalence.
On peut aussi utiliser le permanganate de potassium comme oxydant. Donner la formule brute du permanganate de potassium. KMnO4. Ecrire la configuration électronique de l'atome de manganèse ( Z=25) dans l'état fondamental. 1s2 2s2 2p6 3s2 3p6 4s2 3d5. 1ère série des éléments de transition. Combien d'électrons de valence possède l'atome de manganèse ? 7 électrons. Proposer une formule de Lewis pour l'ion permanganate.
Prévoir la géométrie de cet ion. type AX4, tétraèdre régulier.
|
|||||||
|
|
|||||||
|
|