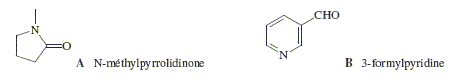|
Synthèse de la nicotine : addition nucléophile, hydrolyse d'un amide, décarboxylation capes agricole 2004
|
|||||||
|
|||||||
|
La synthèse de la nicotine peut être réalisée à partir de la N-méthylpyrrolidinone A et de la 3- formylpyridine B (formules ci-après).
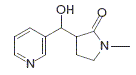
La N-méthylpyrrolidinone présente un caractère légérement acide. Justifier. H situé en a du groupe carbonyle est assez facile à arracher : il présente un caractère acide. Le départ de cet hydrogène conduit à un anion stabilisé par résonance : la charge de ce dernier est délocalisé sur le carbonyle et sur l'azote. La 3-formylpyridine présente un noyau aromatique. Justifier. Un polyène monocyclique et plan comptant 4n+2 électrons p est aromatique. ( Dans ce cas n=1). En présence d’éthanolate de sodium, ces deux composés réagissent mole à mole pour donner après hydrolyse acide le composé C suivant :
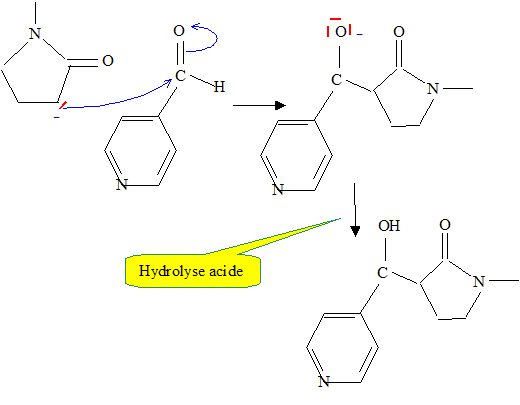
Donner la formule de l’éthanolate de sodium. Quel est son rôle ? CH3-CH2-0- + Na+. L'ion éthanolate est une base forte : celle-ci va arracher le proton en a du carbonyle. Quel nom porte cette suite réactionnelle ? Addition nucléophile sur le carbonyle de B. Proposer un mécanisme pour cette suite réactionnelle.
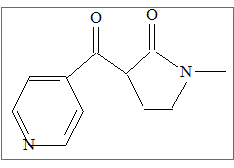
La base conjuguée est très réactive : il vaut mieux qu'elle soit en défaut et que l'autre réactif, B soit en excès : cela évitera à cette base conjuguée de conduire à d'autre réaction. Donc ajout de A, goutte à goutte. Le composé C réagit ensuite avec le dioxyde de manganèse. On obtient D de formule brute C11H12N2O2. La réaction est aisément suivie en spectroscopie infra-rouge. Comment peut-on qualifier la réaction que l’on vient de réaliser ? Oxydation de l'alcool en cétone. Représenter la formule semi-développée du produit D obtenu.
MnO2 + 2e- + 4H+ = Mn2+ + 2H2O, réduction. C11H14N2O2 = C11H12N2O2+ 2e- + 2H+, oxydation. MnO2 +C11H14N2O2+ 2H+ = Mn2+ + 2H2O + C11H12N2O2. Expliquer le choix de la spectroscopie infra-rouge pour le suivi de cette réaction. L'alcool présente une vibration de valence du groupe O-H, large vers 3300 cm-1.
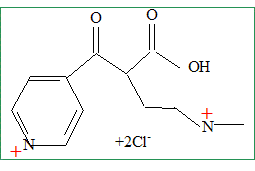
On réalise l’hydrolyse acide du composé D en présence d’acide chlorhydrique concentré et on obtient après recristallisation un composé E de formule brute C11H16N2O3Cl2 (qui est en fait un sel : C11H16N2O32+ + 2Cl- ) Représenter la formule semi-développée du produit E obtenu.
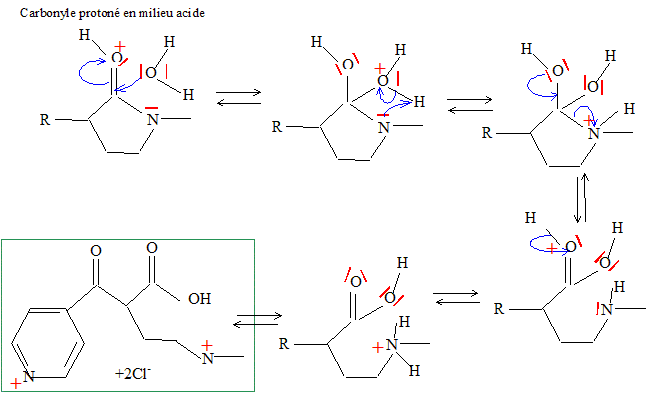
Proposer un mécanisme pour cette réaction. Hydrolyse d'un amide en milieu acide.
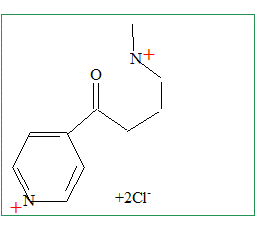
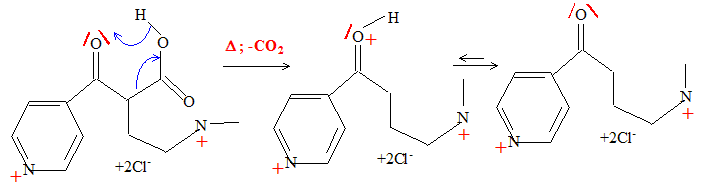
La décarboxylation de E conduit à F de formule brute C10H16N2OCl2. Représenter la formule semi-développée du produit F obtenu.
Proposer un mécanisme pour cette réaction. Décarboxylation d'un acide b cétonique vers 50°C.
Les étapes qui suivent sont indiquées ci-après
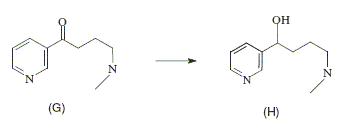
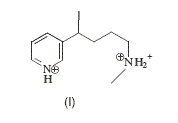
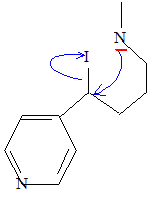
Comment passer simplement de F à G ? Passage en milieu basique. Comment passer simplement de G à H ? Réduction du groupe cétone par NaBH4. Le chauffage de H pendant quelques heures en présence d’acide iodhydrique donne le composé monoiodé I dessiné ci-après.
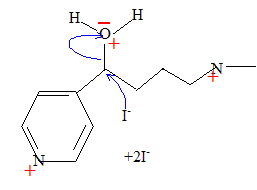
Proposer un mécanisme pour cette réaction et justifier le choix de ce mécanisme. Protonation de l'oxygène du groupe alcoolique en milieu acide : H2O est meilleur nucléofuge que HO-. Puis substitution nucléophile SN2 : I- est un bon nucléophile.
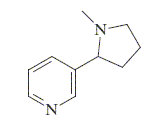
Le chauffage de I en présence de carbonate de sodium conduit finalement à la nicotine :
Montrer que la nicotine présente plusieurs stéréoisomères. Quelle est leur relation ? La molécule possède un atome de carbone asymétrique : d'où l'existence de deux énatiomères. Proposer un mécanisme pour la réaction qui permet de passer de I à la nicotine. Justifier le choix de ce mécanisme.
L'ion carbonate réagit avec H+ formé, ce qui évite : R--NH2 + H+ = RNH3+. Que peut-on dire de la stéréochimie du (des) produit(s) obtenu(s) par cette synthèse ? Justifier. |
|||||||
|
|
|||||||
|
|