|
Dosage des ions chlorures : potentiométrie, conductimétrie capes agricole 2004
|
|||||||
|
|||||||
|
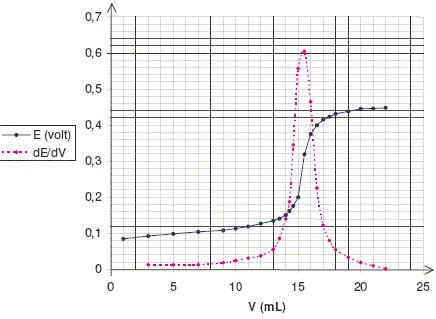
On veut vérifier la teneur en ions chlorure d’un sérum physiologique. Pour cela, on ajoute progressivement une solution de nitrate d’argent de concentration C = 0,100 mol.L-1 à un volume V0 = 50,0 mL d’une solution S préparée en diluant cinq fois le sérum étudié et on suit l’évolution correspondante de la différence de potentiel E entre une électrode d’argent et une électrode au calomel saturé (notée E.C.S.). Les résultats obtenus sont donnés ci-dessous :
Donner l’expression du potentiel d’oxydoréduction de l’E.C.S.. Pourquoi est-il constant à température constante ? L'électrode de référence utilisée ici est une électrode au calomel saturée (ECS), c'est à dire une électrode de platine (Pt) recouverte de mercure (Hg) sur lequel est déposé du calomel Hg2Cl2. Cette électrode est dite saturée car la solution dans laquelle plonge l'électrode ainsi constituée est une solution aqueuse saturée en chlorure de potassium KCl. couple Hg2Cl2 (s)/ Hg (l) : Hg2Cl2 (s)+ 2e- =2 Hg(l) + 2Cl-. Eréf = E°[ Hg2Cl2 (s)/ Hg (l)] + 0,03 log 1/[Cl-]2. Eréf = 0,27 -0,06 log [Cl-]. Dans la solution saturée en KCl : [Cl-] = 4,7 mol/L à 25 °C. E réf = 0,27 -0,06 *log 4,7 = 0,23 V.
Les ions argent, en contact au niveau du verre
fritté (paroi poreuse à
l’extrémité de
l’électrode) avec les ions chlorure de
l’ECS,donne un précipité de
chlorure d’argent. Ce dernier bouche le verre
fritté ; l'électrode devient
inutilisable. On ajoute à l’E.C.S une allonge en
verre remplie d’une solution de nitrate de
potassium. La conduction électrique demeure
; il n'y a plus contact direct entre les ions
chlorure de l'électrode et la solution
contenant les ions Ag+. Déterminer la concentration molaire volumique des ions chlorure dans la solution S puis dans le sérum. Ag+(aq) + Cl-(aq) = AgCl(s). A l'équivalence les quantités de réactifs mis en présence sont en proportions stoechiométriques : C Véq = V0 CS avec Véq = 15,5 mL ( lecture graphe) ; V0 = 50,0 mL ; C= 0,100 mol/L. CS = 0,100*15,5/50,0 = 3,10 10-2 mol/L. Csérum = 5 CS =5* 3,10 10-2 = 0,155 mol/L. Comparer à l’indication portée sur l’étiquette du sérum : 0,9 % en masse de chlorure de sodium. Masse molaire NaCl : M= 35,5+23 = 58,5 g/mol. M*Csérum =58,5*0,155 = 9,07 g/L La densité du sérum est égale à 1 : 0,907 g de NaCl dans 100 g de sérum ou 0,91%. Valeur en accord avec celle de l'étiquette.
CSV0-CV1 = 0,031*50-0,1*10 = 0,55 mmol ; [Cl-(aq)] = 0,55 / (V0+V1 ) = 0,55 / 60 = 9,16 10-3 mol/L. Repport dans (1) : 0,115 = E°(AgCl(s)/Ag(s)-EECS -0,06 log 9,16 10-3 ; E°(AgCl(s)/Ag(s)-EECS = 0,115+0,06 log 9,16 10-3 = -7,3 10-3.(2)
V2 = 20 mL ajouté : après l'équivalence, l'ion argent est en excès de : C(Véq-V1 ) =0,1*(20-15,5) = 0,45 mmol ; [Ag+(aq)] = 0,45 / (V0+V2 ) = 0,45 / 70 = 6,43 10-3 mol/L. (1) et (2) donnent : 0,445 = -7,3 10-3 -0,06 log [Cl-(aq)] ; log [Cl-(aq)] = (-7,3 10-3 -0,445)/ 0,06 = -7,54 ; [Cl-(aq)] = 2,9 10-8 mol/L Ks = [Cl-(aq)] [Ag+(aq)] = 2,9 10-8* 6,43 10-3 ; Ks =1,86 10-10. Déterminer la valeur du potentiel standard d’oxydoréduction du couple Ag+(aq) / Ag(s). (2) donne : E°(Ag+(aq) / Ag(s)) + 0,06 log Ks -EECS = -7,3 10-3. E°(Ag+(aq) / Ag(s)) = -7,3 10-3- 0,06 log 1,86 10-10 +EECS= -7,3 10-3 + 0,583 +0,23 E°(Ag+(aq) / Ag(s)) =0,80 V. Conductimétrie. Le dosage précédent peut également être suivi par conductimétrie. Faire un schéma clair d’une cellule de conductimétrie. Quelle est la grandeur qui est alors effectivement mesurée ? La cellule conductimétrique est constituée de deux plaques rectangulaires de platine platinés, de surface S, parallèles à une distance l sur un support en verre. On mesure la résistance R ( ohm) du volume de liquide délimité par les plaques ; la cellule indique la conductance G = 1/R ( siemens ). En quoi consiste l’étalonnage d’un conductimètre ? Le fabricants fournit une table de la conductivité d’une solution de chlorure de potassium à 0,1 mol /L pour toutes les températures allant de 15,0 à 30,0°C. On mesure alors la conductance de cette solution de chlorure de potassium et la température de la solution. Les conductimétres sont munis d’un potentiométre d’étalonnage qui permet d’ajuster la valeur lue à la valeur donnée par la table du fabricant. Est-il utile d’étalonner un conductimètre pour réaliser un dosage conductimétrique ? Non : afin de déterminer le volume équivalent, on recherche l'intersection de deux droites. Quelles sont les conditions nécessaires pour obtenir des portions de droites lors d’un dosage conductimétrique ? Le volume de la solution du bécher doit être paratiquement constant : utiliser un grand volume de solution à titrer ( ajouter de l'eau distillée) et ajouter à la burette graduée, un petit volume de solution titrante ( donc beaucoup plus concentrée que la solution à titrer).
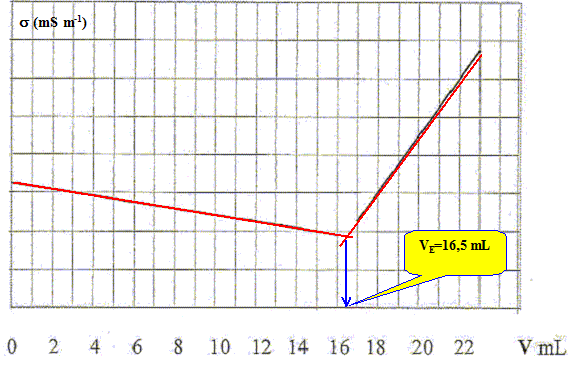
Les conductivités molaires ioniques limites ( mS.m2.mol-1) de quelques ions sont indiquées ci-dessous : l° Na+ = 5,01 ; l° Cl- = 7,63 ; l° Ag+ = 6,19 ; l° NO3-= 7,14. Indiquer l’allure de la courbe donnant les variations du produit : «conductivité . Volumesolution»
Pour justifier le tracé ainsi réalisé, donner l’expression et la valeur des pentes des portions de droites obtenues. Equation de la réaction associée à ce dosage : Ag+ aq + Cl- aq ---> AgCl solide. Avant l'équivalence : L'ion argent est en défaut ; l'ion chlorure est en excès ; les ions nitrate et sodium sont spectateurs. ( les ions oxonium et hydroxyde sont minoritaires) s = lNa+[Na+] + lCl-[Cl-] + lNO3-[NO3-] On ajoute x = CV mol d'ion argent ( qui demeure en défaut ) et x = CV mol d'ion nitrate. x mol d'ion chlorure disparaissent : du point de vue de la conductivité, tout se passe comme si on remplaçait l'ion chlorure par l'ion nitrate. Or lCl- > lNO3- donc la conductivité de la solution diminue. On note V0 le volume de la solution dans le becher et V le volume de nitrate d'argent ajouté à la burette. On note C la concentration du nitrate d'argent et CS celle du chlorure de sodium. [Na+] =V0 CS / (V0+V) ; [Cl-] =(V0 CS -C V)/ (V0+V) ; [NO3-] =CV/ (V0+V) s = [lNa+V0 CS + lCl-(V0 CS -C V)+ lNO3-CV]/ (V0+V) s = [(lNa+ + lCl-) V0 CS + ( lNO3- -lCl-)CV]/ (V0+V) s (V0+V) = (lNa+ + lCl-) V0 CS + ( lNO3- -lCl-)CV On trace s (V0+V) = f(V) : droite de pente : ( lNO3- -lCl-)C = (7,14-7,63)*0,1 = -0,049 S m-1.
L'ion chlorure est en défaut ; l'ion argent est en excès ; les ions nitrate et sodium sont spectateurs. ( les ions oxonium et hydroxyde sont minoritaires) s = lNa+[Na+] + lAg+[Ag+] + lNO3-[NO3-] on ajoute x = CV mol d'ion argent ( qui est en excès de C(V-VE) ) et x = CV mol d'ion nitrate. L'ajout d'ions en solution se traduit par une augmentation de la conductivité de la solution. [Na+] =V0 CS / (V0+V) ; [Ag+] =C(V-VE)/ (V0+V) ; [NO3-] =CV/ (V0+V) s = [lNa+V0 CS + lAg+C(V-VE)+ lNO3-CV]/ (V0+V) s = [lNa+V0 CS - lAg+C VE + ( lNO3- +lAg+)CV]/ (V0+V) ; or V0 CS = C VE s (V0+V) = (lNa+ - lAg+ ) VE C + ( lNO3- +lAg+)CV On trace s (V0+V) = f(V) : droite de pente :( lNO3- +lAg+)C = (7,14+6,19)*0,1 = +1,33 S m-1. |
|||||||
|
|
|||||||
|
|