|
chlorure de sulfuryle SO2Cl2 : enthalpie, déplacement d'équilibre ; cinétique capes agricole 2004
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le chlorure de sulfuryle SO2Cl2 est un des agents chlorants qui peuvent être utilisés. C’est un agent chlorant assez doux et sélectif. Étude thermodynamique de la synthèse du chlorure de sulfuryle : L’équation de la synthèse s’écrit : SO2 (g) + Cl2 (g) = SO2Cl2 (g)
Déterminer l’enthalpie standard de la réaction : DrH° = DfH°(SO2Cl2 )-DfH°(SO2 ) DrH° = -354,8-(-296,8) = -58 kJ mol-1. Déterminer l’entropie standard de la réaction. Interpréter le signe de cette grandeur. DrS° = S°(SO2Cl2 )-S°(SO2 )-S°(Cl2 ) DrS° =311,1-223,1-248,2 = -160,2 J K-1 mol-1. Le nombre de moles passe de 2 à 1 ( deux réactifs et un seul produit) : l'ordre augmente, l'entropie de la réaction est négative. Déterminer l’enthalpie libre standard de la réaction dans le cadre de l’hypothèse d’Ellingham pour q1 = 102 °C et q2 = 270 °C. DrG = DrH° -TDrS° . T1 = 273+102=375 K ; T1 = 273+270=543 K ; DrG1 = -58 103-375*(-160,2)= 2075 J mol-1. DrG2 = -58 103-543*(-160,2)= 2,9 104 J mol-1.
Vérifier que les constantes d’équilibre pour les températures q1 et q2 valent respectivement : K1 = 0,51 et K2 = 1,6 10-3. DrG =-RTln K. ln K1 = -DrG1 /(RT1) =-2075/(8,314*375)= -0,665 ; K1 =0,51. ln K2 = -DrG2 /(RT2) =-2,9 104/(8,314*543)= -6,42 ; K1 =1,6 10-3.
La réaction est exothermique
(DrH°
<0). Une diminution de température
déplace l'équilibre dans le sens
direct. Même question
pour une baisse isotherme de la
pression. Le nombre total de moles diminue : une baisse de
pression ( diminution du nombre de moles)
déplace l'équilibre dans le sens
indirect. Dans ce cas, on parle de catalyse hétérogène. Définir ce terme. Le catalyseur et les réactifs n'appartienent pas à la même phase.
Dans une enceinte, à q1 = 102 °C, sous une pression constante et égale à 3,00 bar, on introduit 0,10 mol de dichlore Cl2, 0,40 mol de dioxyde de soufre SO2, et 0,15 mol de chlorure de sulfuryle SO2Cl2. Dans quel sens évolue le système ? Justifier. Nombre total de moles : N = 0,1+0,4+0,15 = 0,65 mol fractions molaires xCl2 = 0,1/0,65 = 0,154 ; xSO2 = 0,4/0,65 = 0,615 ; xSO2Cl2 = 0,15/0,65 = 0,231. Pressions partielles initiales : PCl2 = xCl2 P = 0,462 bar ; PSo2 = xSO2 P = 1,85 bar ; PSO2Cl2 =xSO2Cl2 P =0,693 bar. Quotient initial de réaction : Q r i = PSO2Cl2 / (PSo2 *PCl2 ) =0,693/(1,85*0,462) = 0,81. Valeur supérieure à K1, l'équilibre est déplacé dans le sens indirect.
Déterminer la variance du système à l’équilibre. Interpréter le résultat. 3 constituants ; 1 relation entre constituants : n=2 constituants indépendants ; la température et la pression sont fixées. hypothèse 1 : produit et réactifs gazeux : une seule phase j=1 ; variance : n-j=1. La composition du système va évoluer. hypothèse 2 : produit liquide et réactifs gazeux : deux phases j=2 ; variance : n-j=0. Système invariant. Déterminer le coefficient de dissociation du chlorure de sulfuryle dans le cas où : a/ P = 1,00 bar et q1 = 102 °C b/ P = 1,00 bar et q2 = 270 °C
Pressions partielles à l'équilibre : PCl2 = xP/(1+x) ; PSo2 = xP/(1+x) ; PSO2Cl2 =(1-x)P/(1+x) . Constante d'quilibre : K = PSO2Cl2 / (PSo2 *PCl2 ) = (1-x) (1+x)/ (x2P) a/ P = 1,00 bar et q1 = 102 °C : K= 0,51. 0,51x2 = 1-x2 ; 1,51x2 =1 d'où x = 0,81. b/ P = 1,00 bar et q2 = 270 °C. 1,6 10-3x2 = 1-x2 d'où x = 0,999 ; x = 1.
Étude cinétique de la décomposition du chlorure de sulfuryle : À la température de 270 °C, on peut considérer que la dissociation du chlorure de sulfuryle en dichlore et dioxyde de soufre est totale. L’équation de la réaction correspondante s’écrit : SO2Cl2(g) = SO2(g) + Cl2(g) Les constituants, tous gazeux, se comportent comme des gaz parfaits. On introduit du chlorure de sulfuryle dans un récipient indéformable vidé au préalable. L’ensemble est porté à 270°C et on mesure l’évolution au cours du temps de la pression totale P en fonction du temps. Les résultats obtenus sont rassemblés dans le tableau ci-dessous :
Nombre total de moles : n= n0 +x ; nfinal = 2n0. n0 = P0V/(RT)= Cte * P0 ; n = Cte * P ; nfinal =Cte Pfinal ; 2n0 = Cte Pfinal ; Pfinal =2 P0 = 2*0,4079 = 0,8158 bar. Montrer que la pression partielle du chlorure de sulfuryle noté A, P(A), peut s’exprimer en fonction de la pression totale P à l’instant t et de la pression initiale P0 selon la relation : P(A) = 2 P0 – P. n0 = P0V/(RT)= Cte * P0 =AP0 ; nombre totale de moles à la date t : n0+x = A P ; x = AP-n0 = AP-AP0 ; n0-x = 2AP0-AP ; (n0-x )/(n0+x) = ( 2P0-P) /P Pression partielle de SO2Cl2 : P(A) = (n0-x)P / (n0+x). P(A) =2P0-P. Montrer que les résultats expérimentaux sont en accord avec une cinétique d’ordre 1. En déduire la constante de vitesse à 270 °C.
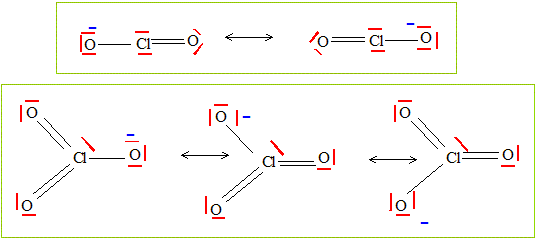
Écrire les formules mésomères les plus contributives de l’ion chlorite ClO2- et de l’ion chlorate ClO3-. Dans les formules de ces ions, l’atome central est représenté en gras.
Pourquoi les distances chlore – oxygène sont-elles identiques dans l’ion chlorite ? Cette distance sera notée d1. Deux formules mésomères dans lesquelles les distances Cl-O sont identiques, intermédiaires entre une liaison simple et une liaison double. Pourquoi les distances chlore – oxygène sont-elles identiques dans l’ion chlorate ? Cette distance sera notée d2. Trois formules mésomères dans lesquelles les distances Cl-O sont identiques, intermédiaires entre une liaison simple et une liaison double : mais le caractère de double liaison est plus marqué que dans l'ion chlorite. Comparer les longueurs des liaisons chlore – oxygène d1 et d2. Justifier. Les liaisons Cl-O dans l'ion chlorate ont un caractère de double liaison plus marqué que dans l'ion chlorite : d2 < d1.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|