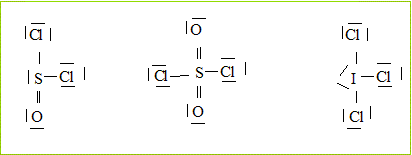|
élément chlore : diagramme orbitales moléculaires ; VSEPR ; mésomérie capes agricole 2004
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
Le dichlore Cl2 a été synthétisé pour la première fois par le chimiste suédois C.W. Scheele en 1774. En 1810, le chimiste anglais Sir H. Davy identifia ce gaz comme un corps simple et l’appela «chlore» en raison de sa couleur vert-jaune (du grec chloros vert). Le gaz dichlore est fortement toxique et très irritant pour les poumons. Quelques définitions. Quelle grandeur caractérise un élément chimique ? Que représente-t-elle ? Le numéro atomique Z, ou nombre de charge, nombre de protons du noyau. Z indique la position de l'élément dans la classification périodique. Où est situé l’élément chlore dans la classification périodique ? À quelle famille appartient-il ?Citer deux autres éléments de cette famille. 17 ème colonne, 3 ème période, famille des halogènes ( fluor, chlore, brome, iode). Définir un corps simple puis un corps composé. Un corps pur est composé d'un seul type de constituant : Un corps pur simple est constitué d'un seul type d'atome ; un corps pur composé est constitué d'atomes de plusieurs sortes. Le chlore naturel existe sous deux formes isotopiques le chlore 35, de masse molaire atomique M1 = 34,969 g.mol-1, et le chlore 37, de masse molaire atomique M2 = 36,966 g.mol-1. La masse molaire atomique du chlore naturel vaut M = 35,453 g.mol-1. En déduire l’abondance relative de ces deux isotopes. x : pourcentage massique de chlore 37. xM2+(100-x)M1 = 100 M ; x = 100(M -M1) / (M2-M1) x = 48,4 / 1,997 = 24,2 % ; 75,8 % chlore 35.
Etablir la configuration électronique de l’atome de chlore dans son état fondamental après avoir rappelé les règles qui doivent être utilisées pour cela. Règles permettant d'établir la structure électronique d'un atome polyélectronique : Règle de Pauli : deux électrons se différencient par au moins l'un de leur nombres quantiques n, l, m et s. Règle de Klechkowski : l'ordre de remplissage des orbitales se fait suivant (n+l) croissant ; si deux orbitales atomiques ont le même nombre (l+n), celle qui a la plus faible valeur de n est remplie en premier ( principe de stabilité) 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f... Règle de Hund : cas des orbitales de mêmes énergie. Les électrons de spins parallèles occupent le maximum d'orbitales. Configuration électronique du chlore dans l'état fondamental :1s2 2s2 2p6 3s2 2p5 . Quels nombres d’oxydation peut-on prévoir pour le chlore ? La notion de nombre d'oxydation n.o d'un élément est intéressante pour voir son évolution dans divers composés. exemple de l'élément chlore
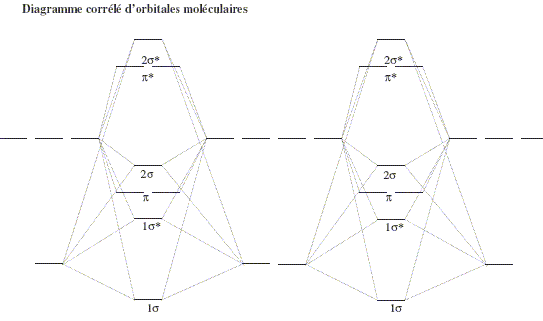
Les orbitales moléculaires de la
molécule de dichlore résultent de
l’interaction des orbitales atomiques de valence des deux atomes de chlore
mis en jeu. L’axe passant par les deux noyaux de chlore est l’axe z’z. Quelles sont les
orbitales de valence d’un atome de chlore
? 3s2 2p5 Les diagrammes d’orbitales
moléculaires des molécules
diatomiques homonucléaires mettant en jeu des éléments de la
troisième période sont
corrélés. Leur allure est
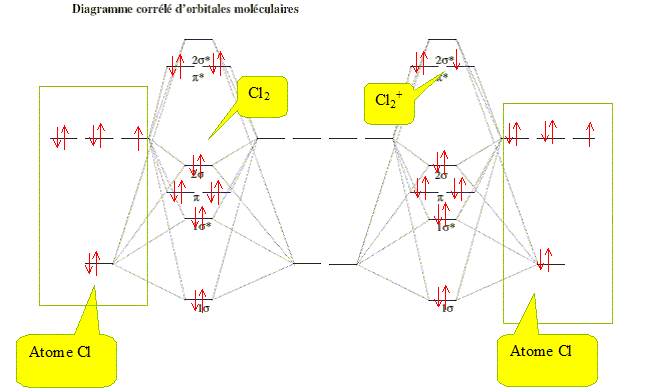
donnée ci-dessous. Que signifie le terme corrélé ? Corrélation électronique : description de l'interaction entre électrons dans un système quantique dont on considère la structure électronique. Le mot " corrélation " en mathématiques statistiques indique que deux fonctions de distribution, f et g, dépendent l'une de l'autre. Déterminer la configuration électronique de valence de la molécule de dichlore Cl2 et de l’ion Cl2+ dans leur état fondamental.
Indice de liaison dans Cl2 : 8 électrons dans les OM liantes et 6 dans les OM anti-liantes n = (8-6)/2 = 1. Indice de liaison dans Cl2+ : 8 électrons dans les OM liantes et 5 dans les OM anti-liantes n = (8-5)/2 =1,5. Dans lequel de ces deux édifices la distance internucléaire d’équilibre est-elle la plus courte ? En arrachant un électron anti-liant, la molécule Cl2+ est stabilisée : l'indice de liaison augmente et la longueur de liaison diminue. Quelles sont les orbitales frontières de la molécule de dichlore ? Plus haute orbitale moléculaire occupée : p* Plus basse orbitale moléculaire inoccupée : 2s*. Ces orbitales spécifiques
sont appelées "orbitales frontières".
Quelle est la couleur de ces radiations ? Donner un ordre de grandeur de leur longueur d’onde dans le vide.
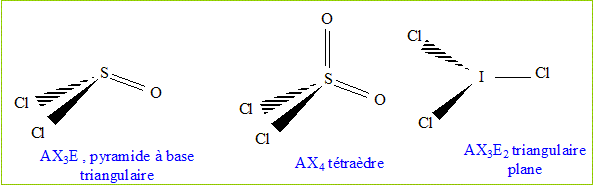
Etude de quelques composés contenant l’élément chlore. Établir la représentation de Lewis des espèces polyatomiques suivantes dont l’atome central est représenté en gras et dont la formule est écrite de façon à traduire l’enchaînement : le chlorure de thionyle OSCl2 (a) ; le chlorure de sulfuryle O2SCl2 (b) ; le trichlorure d’iode ICl3 (c).
Déterminer, à l’aide de la méthode VSEPR, la géométrie des édifices (a) et (b) au niveau del’atome de soufre central et celle de l’édifice (c).
Dans l’édifice (c), peut-on remplacer l’atome d’iode par un atome de fluor ? Justifier la réponse. Non, le fluor est trop petit, trop électronégatif et ne possède pas d'orbitales d disponibles.
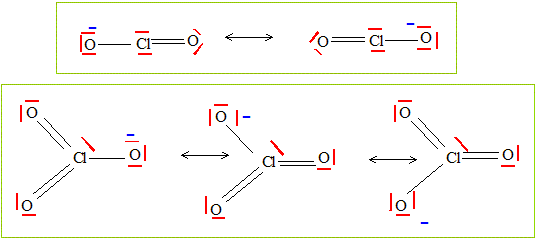
Écrire les formules mésomères les plus contributives de l’ion chlorite ClO2- et de l’ion chlorate ClO3-. Dans les formules de ces ions, l’atome central est représenté en gras.
Pourquoi les distances chlore – oxygène sont-elles identiques dans l’ion chlorite ? Cette distance sera notée d1. Deux formules mésomères dans lesquelles les distances Cl-O sont identiques, intermédiaires entre une liaison simple et une liaison double. Pourquoi les distances chlore – oxygène sont-elles identiques dans l’ion chlorate ? Cette distance sera notée d2. Trois formules mésomères dans lesquelles les distances Cl-O sont identiques, intermédiaires entre une liaison simple et une liaison double : mais le caractère de double liaison est plus marqué que dans l'ion chlorite. Comparer les longueurs des liaisons chlore – oxygène d1 et d2. Justifier. Les liaisons Cl-O dans l'ion chlorate ont un caractère de double liaison plus marqué que dans l'ion chlorite : d2 < d1.
|
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|