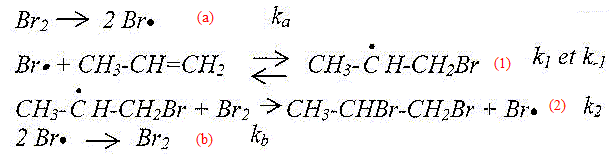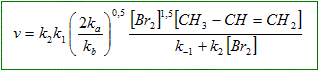|
addition radicalaire du dibrome sur un alcène concours Capes interne 2008 |
|||||||
|
|||||||
|
CH3-CH=CH2 + Br2 = CH3-CHBr-CH2Br. Le mécanisme proposé est le suivant :
Quel est le rôle de l'irradiation UV ? Qualifier le type de rupture de liaison observé dans le premier acte élémentaire. Création d'intermédiaires réactionnels de type radicalaire. Rupture homolytique de la liaison Br-Br. Identifier, en les nommant, les différentes phases du mécanisme en chaîne . Initiation : étape a, création
d'intermédiaires réactionnels. Propagation : étapes 1 et 2, consommation
puis régénération de ces
intermédiaires. Terminaison : étape b, disparition des
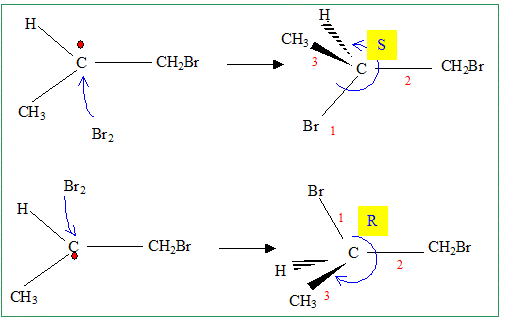
intermédiaires réactionnels. Discuter de la stéréochimie de la réaction. Le mélange réactionnel obtenu présente t-il une activité optique ? Justifier. Etape 1 : l'intermédiaire réactionnel radicalaire est plan. Le radical primaire est moins stable que le radical secondaire : c'est ce dernier qui se forme. étape 2 : l'attaque du dibrome est équiprobable de chaque côté du plan. On obtient un mélange racémique.
Déterminer, d'après le mécanisme réactionnel proposé, la vitesse de formation du dérivé dihalogéné en fonction des concentration des réactifs et des constantes de vitesse. CH3-CH=CH2 + Br2 = CH3-CHBr-CH2Br. vitesse de formation du 1,2-dibromopropane : v = d[CH3-CHBr-CH2Br]/dt principe de Bodenstein (approximation aux états quasi-stationnaires). Les intermédiaires réactionnels restent en quantité pratiquement constante et très faible. d[intermédiaire] / dt =0 d[Br.]/dt = 2ka[Br2]- k1[Br.][CH3-CH=CH2] +k-1[CH3-.CH-CH2Br]+ k2[CH3-.CH-CH2Br][Br2]- kb[Br.]2=0. (1) d[CH3-.CH-CH2Br] /dt = k1[Br.][CH3-CH=CH2]-k-1[CH3-.CH-CH2Br]-k2[CH3-.CH-CH2Br][Br2]=0. (2) (1) + (2) donne : 2ka[Br2] = kb[Br.]2 soit : [Br.] =(2ka/kb[Br2] )½. Repport dans (2) : k1(2ka/kb[Br2] )½[CH3-CH=CH2]-k-1[CH3-.CH-CH2Br]-k2[CH3-.CH-CH2Br][Br2]=0 [CH3-.CH-CH2Br] (k-1 +k2[Br2]) = k1(2ka/kb[Br2] )½[CH3-CH=CH2] [CH3-.CH-CH2Br] = k1(2ka/kb[Br2] )½[CH3-CH=CH2] /(k-1 +k2[Br2]). d[CH3-CHBr-CH2Br]/dt = k2[CH3-.CH-CH2Br][Br2]
Quel ordre global peut-on prévoir pour la cinétique de cette réaction ? Si k2[Br2] >>k-1 alors v = k1(2ka/kb)½[Br2]½[CH3-CH=CH2] Ordre partiel : 1 pour le propène ; 0,5 pour le dibrome. Ordre global : 1,5. Si k2[Br2] de l'ordre de grandeur de k-1 alors l'ordre n'est pas défini pour le dibrome.
|
|||||||
|
|
|||||||
|
|